题目内容
在10L密闭容器中,A、B、C三种气态物质构成可逆反应体系,其关系如图所示。下列说法错误的是

- A.0~4分钟时,A的平均反应速率为0.01mol·L-1·min-1
- B.由T1向T2变化时,V正>V逆
- C.此反应的正反 应为吸热反应
- D.其它条件不变,加压,达新平衡时,C的体积分数增大
C
试题分析:0~4分钟时,A的平均反应速率为(2.4-2.0)/10/4=0.01mol·L-1·min-1 ,故A正确;由右边的图可以知道,温度升高,随着反应的进行,C的百分含量逐渐增加,当到达T3时,达到平衡,故由T1向T2变化时,V正>V逆,故B正确,当达到平衡时,增加温度C的百分含量减少,所以该反应为放热反应,故C错误,为本题的正确答案;由左边的图可以看出在反应达到平衡是消耗了0.8mol的A,0.4mol的B,生成了0.4mol的C,所以可以得到以下方程是2A+B=C,所以其它条件不变,加压,达新平衡时,C的体积分数增大,故D正确。
考点:化学平衡
试题分析:0~4分钟时,A的平均反应速率为(2.4-2.0)/10/4=0.01mol·L-1·min-1 ,故A正确;由右边的图可以知道,温度升高,随着反应的进行,C的百分含量逐渐增加,当到达T3时,达到平衡,故由T1向T2变化时,V正>V逆,故B正确,当达到平衡时,增加温度C的百分含量减少,所以该反应为放热反应,故C错误,为本题的正确答案;由左边的图可以看出在反应达到平衡是消耗了0.8mol的A,0.4mol的B,生成了0.4mol的C,所以可以得到以下方程是2A+B=C,所以其它条件不变,加压,达新平衡时,C的体积分数增大,故D正确。
考点:化学平衡

练习册系列答案
相关题目
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系,当在某一温度时,A、B、C物质的量与时间的关系如图1,C的百分含量与温度的关系如图2.
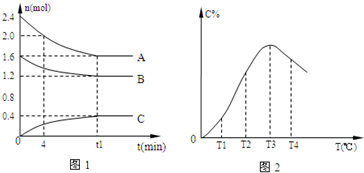
下列分析不正确的是( )

下列分析不正确的是( )
| A、0~4分钟时,A的平均反应速率为0.02mol/(L?min) | ||
B、该反应的平衡常数表达式K=
| ||
| C、由T1向T2变化时,V正>V逆 | ||
| D、此反应的正反应为放热反应 |


 在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则:
在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则: