题目内容
(1)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)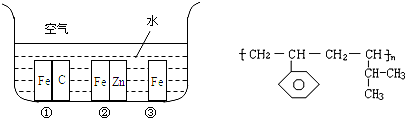
(2)某高分子材料的结构如图,则其对应的单体的结构简式为:
(3)在10L密闭容器中充入2molA和1molB,发生的化学反应:3A(g)+B(g)?C(g)+2D(g),2min后反应达到平衡,在相同温度下,测得平衡时容器内气体的压强是反应前的5/6,试填写下列空白:
①用气体B表示的2min内的平均反应速率为
②平衡时,A的浓度为
(4)我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务.某种氢氧燃料电池的电解液为KOH溶液.电池负极反应为
分析:(1)金属腐蚀的速度:原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀;
(2)解答此类题目,首先要根据高聚物的结构简式判断高聚物是加聚产物还是缩聚产物,然后根据推断单体的方法作出判断,
加聚产物的单体推断方法:
a、凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可;
b、凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合即可;
c、凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换;
(3)根据化学反应中的三行式结合反应速率公式v=
进行计算;
(4)根据氢氧燃料电池的工作原理进行回答.
(2)解答此类题目,首先要根据高聚物的结构简式判断高聚物是加聚产物还是缩聚产物,然后根据推断单体的方法作出判断,
加聚产物的单体推断方法:
a、凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可;
b、凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合即可;
c、凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换;
(3)根据化学反应中的三行式结合反应速率公式v=
| △c |
| △t |
(4)根据氢氧燃料电池的工作原理进行回答.
解答:解:(1)铁处于Ⅰ的环境中做原电池的负极,腐蚀速率较快,铁处于Ⅱ的环境中做原电池的正极,被保护,腐蚀速率很慢,铁处于Ⅲ的环境中的金属铁发生吸氧腐蚀,速度较慢,故答案为:①>③>②;
(2)该高聚物的形成过程属于加聚反应,加聚反应是由不饱和单体( 如 碳碳双键,碳碳叁键以及碳氧双键等) 聚合高分子的反应,其产物只有一种高分子化合物.
凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合即可,直接合成该高聚物的物质为: ,
, ,故答案为:
,故答案为: ;
; ;
;
(3)①设B的变化浓度是x,
3A(g)+B(g)?C(g)+2D(g)
初始浓度:0.2 0.1 0 0
变化浓度:3x x x 2x
平衡浓度:0.2-3x 0.1-x x 2x
反应达到平衡,在相同温度下,测得平衡时容器内气体的压强是反应前的5/6,则
=
,解得x=0.05mol/L,所以气体B表示的2min内的平均反应速率v=
=0.025mol/(L?min),故答案为:0.025mol/(L?min);
②平衡时,A的浓度为0.2-3x=0.05mol/L,故答案为:0.05mol/L;
(4)在燃料点池中,负极上是氢气发生失电子的氧化反应,即2H2-4e-+40H-=4H2O,正极上是氧气发生得电子的还原反应,即O2+2H2O+4e-=40H-,故答案为:2H2-4e-+40H-=4H2O;O2+2H2O+4e-=40H-.
(2)该高聚物的形成过程属于加聚反应,加聚反应是由不饱和单体( 如 碳碳双键,碳碳叁键以及碳氧双键等) 聚合高分子的反应,其产物只有一种高分子化合物.
凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合即可,直接合成该高聚物的物质为:
 ,
, ,故答案为:
,故答案为: ;
; ;
;(3)①设B的变化浓度是x,
3A(g)+B(g)?C(g)+2D(g)
初始浓度:0.2 0.1 0 0
变化浓度:3x x x 2x
平衡浓度:0.2-3x 0.1-x x 2x
反应达到平衡,在相同温度下,测得平衡时容器内气体的压强是反应前的5/6,则
| (0.2-3x+0.1-x+x+2x)×10 |
| (0.2+0.1)×10 |
| 5 |
| 6 |
| 0.05mol/L |
| 2min |
②平衡时,A的浓度为0.2-3x=0.05mol/L,故答案为:0.05mol/L;
(4)在燃料点池中,负极上是氢气发生失电子的氧化反应,即2H2-4e-+40H-=4H2O,正极上是氧气发生得电子的还原反应,即O2+2H2O+4e-=40H-,故答案为:2H2-4e-+40H-=4H2O;O2+2H2O+4e-=40H-.
点评:本题考查知识的较多,涉及化学平衡的计算、聚合物及反应速率的计算等,注意聚合物寻找单体的方法,注意聚合反应的类型来分析,难度不大.

练习册系列答案
相关题目
 (1)如图所示是实验室中制取气体的一种简易装置.①甲同学用下列方法检验装置的气密性,请问能否达到目的
(1)如图所示是实验室中制取气体的一种简易装置.①甲同学用下列方法检验装置的气密性,请问能否达到目的 (1)如图所示是实验室中制取气体的一种简易装置.①甲同学用下列方法检验装置的气密性,请问能否达到目的______ (填能或否)
(1)如图所示是实验室中制取气体的一种简易装置.①甲同学用下列方法检验装置的气密性,请问能否达到目的______ (填能或否)
 (1)如图所示是实验室中制取气体的一种简易装置.①甲同学用下列方法检验装置的气密性,请问能否达到目的 (填能或否)
(1)如图所示是实验室中制取气体的一种简易装置.①甲同学用下列方法检验装置的气密性,请问能否达到目的 (填能或否)