题目内容
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p?的关系如图所示,请判断下列说法正确的是( )


| A、降温,化学平衡向逆反应方向移动 |
| B、使用催化剂可使D%有所增加 |
| C、化学方程式中气体的化学计量数m<p+q? |
| D、B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
考点:体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:A、由图Ⅰ根据先拐先平数值大可知,T2>T1,升高温度,D的含量减小,平衡逆向移动;
B、催化剂对化学平衡无影响;
C、由图Ⅱ根据先拐先平数值大可知,P2>P1,增大压强,D的含量减小,平衡逆向移动;
D、B的颗粒越小,接触面积越大,可以加快化学反应速率,但对化学平衡无影响.
B、催化剂对化学平衡无影响;
C、由图Ⅱ根据先拐先平数值大可知,P2>P1,增大压强,D的含量减小,平衡逆向移动;
D、B的颗粒越小,接触面积越大,可以加快化学反应速率,但对化学平衡无影响.
解答:
解:A、由图Ⅰ根据先拐先平数值大可知,T2>T1,升高温度,D的含量减小,平衡逆向移动,故降低温度,平衡正向移动,故A错误;
B、催化剂对化学平衡无影响,不会使D%有所增加,故B错误;
C、由图Ⅱ根据先拐先平数值大可知,P2>P1,增大压强,D的含量减小,平衡逆向移动,故m<p+q,故C正确;
D.B的颗粒越小,接触面积越大,可以加快化学反应速率,但对化学平衡不产生影响,故D错误.
故选:C.
B、催化剂对化学平衡无影响,不会使D%有所增加,故B错误;
C、由图Ⅱ根据先拐先平数值大可知,P2>P1,增大压强,D的含量减小,平衡逆向移动,故m<p+q,故C正确;
D.B的颗粒越小,接触面积越大,可以加快化学反应速率,但对化学平衡不产生影响,故D错误.
故选:C.
点评:本题考查外界条件对化学反应速率和化学平衡的影响,难度中等.要注意催化剂和颗粒大小对化学平衡不产生影响.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,2.24L水中所含的电子数为NA |
| B、常温常压下,16g O3所含的原子数为NA |
| C、0.1molNa2O2晶体中所含的离子数为0.4NA |
| D、1molFe在氧气中充分燃烧失去的电子数为3NA |
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、钢铁的腐蚀过程绝大多数都是电化学腐蚀 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C、电解CuCl2饱和溶液,生成金属铜和氯气 |
| D、电解MgCl2饱和溶液,可制得金属镁 |
下列说法不正确的是( )
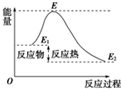

| A、反应物分子(或离子)间的每次碰撞是反应的先决条件 |
| B、反应物的分子的每次碰撞都能发生化学反应 |
| C、活化分子具有比普通分子更高的能量,催化剂能够减低活化能的数值 |
| D、活化能是活化分子的平均能量与所有分子平均能量之差,如图所示正反应的活化能为E-E1 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA |
| C、在常温常压下,11.2 L Cl2含有的分子数为0.5 NA |
| D、标准状况下,11.2 L H2O含有的分子数为0.5 NA |
下列化学用语或表达式正确的是( )
| A、Na+的电子排布式:1S22S22P6 |
| B、乙烯的结构简式CH2CH2 |
C、N原子最外层轨道表示式: |
D、 |
 名称:
名称: