题目内容
4.近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:Ⅰ.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=+218.4kJ•mol-1
Ⅱ.CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H2=-394.0kJ•mol-1
(1)若用K1、K2分别表示反应Ⅰ、Ⅱ的化学平衡常数,则反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g)的平衡常数K=$\sqrt{({K}_{1}×{K}_{2})}$(用含K1、K2的式子表示).
(2)某科研小组研究在其他条件不变的情况下,改变起始一氧化碳物质的量对反应Ⅱ的影响,实验结果如图1所示(图中T表示温度).
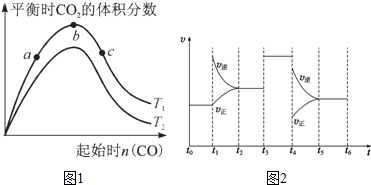
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是c.
②图象中T2高于(填“高于”、“低于”、“等于”或“无法确定”)T1,判断的理由是该反应为放热反应,升高温度平衡向逆反应方向移动,CO2体积分数降低,故T2高于T1.
(3)反应3X+Y?2Z在2min达到平衡后的t1~t6内反应速率与反应时间图象如图2,在每一时刻均改变一个影响反应速率的因素,则B
A.在t1时增大了压强
B.在t3时加入了催化剂
C.在t4时降低了温度
D.t2~t3时A的转化率最高.
分析 (1)由Ⅰ.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)、
Ⅱ.CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)
可知,(I+Ⅱ)×$\frac{1}{2}$得到$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g);
(2)对反应CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H<0,
①温度相同时,CO越多,SO2的转化率越高;
②相同CO时,升高温度,平衡逆向移动,CO2的体积分数越小;
(3)由t1~t6内反应速率与反应时间图象可知,t1时逆反应速率大于正反应速率,平衡逆向移动;t3时平衡不移动;t4时逆反应速率大于正反应速率,平衡逆向移动,以此来解答.
解答 解:(1)由Ⅰ.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)、
Ⅱ.CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)
可知,(I+Ⅱ)×$\frac{1}{2}$得到$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g),则反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g)的平衡常数K=$\sqrt{({K}_{1}×{K}_{2})}$,
故答案为:$\sqrt{({K}_{1}×{K}_{2})}$;
(2)对反应CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H<0,
①温度相同时,CO越多,SO2的转化率越高,则a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是c,故答案为:c;
②该反应为放热反应,相同CO时,升高温度,平衡逆向移动,CO2的体积分数减小,则T2高于T1,
故答案为:高于;该反应为放热反应,升高温度平衡向逆反应方向移动,CO2体积分数降低,故T2高于T1;
(3)由t1~t6内反应速率与反应时间图象可知,t1时逆反应速率大于正反应速率,平衡逆向移动;t3时平衡不移动;t4时逆反应速率大于正反应速率,平衡逆向移动,A.在t1时若增大了压强,平衡正向移动,正反应速率大于逆反应速率,故A不选;
B.在t3时加入了催化剂,正逆反应速率均增大,平衡不移动,故B选;
C.反应的焓变未知,在t4时不一定降低了温度,故C不选;
D.由上述分析可知,平衡一直逆向移动,则t0~t1时A的转化率最高,故D不选;
故答案为:B.
点评 本题考查化学平衡的计算,为高频考点,把握K与反应的关系、平衡移动、图象分析等为解答的关键,侧重分析与应用能力的考查,注意图象与平衡移动原理的结合,题目难度不大.

 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
| A. |  如图可表示合成氨过程中的能量变化 | |
| B. | a的数值为391 | |
| C. | Q1的数值为92 | |
| D. | 相同条件下,反应物若为2 mol N2和6 mol H2,放出热量Q2>2Q1 |
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 | |
| C. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为1.
(2)下列说法中能说明该反应达到了化学平衡状态的是AC.
A.容器内压强一定 B.容器内气体的密度一定C.容器内Z分子数一定 D.容器内气体的质量一定
(3)温度维持T℃不变,若起始时向容器M中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是A (稀有气体不参与反应).
A.2mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1mol X、0.5mol Y、0.5a mol Z、0.5mol W D.2mol X、1mol Y、1mol Z
(4)温度维持T℃不变,若起始时向容器M中加入4mol X和6mol Y,若达到平衡时容器内的压强减小了10%,则反应中放出的热量为QkJ.
(5)温度维持T℃不变,若在一个和原容器体积相等的恒压容器N 中,加入2mol X和1mol Y发生如上反应并达平衡,则N(选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M>N(选填>、<、=符号).
(6)已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
| IA | 0 | ||||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | |||
| 2 | ① | ② | Ne | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
(1)①元素符号是C.
(2)元素⑤的原子结构示意图是
 .
.(3)③、④两种元素的金属性强弱关系:③>④(填“>”或“<”).
(4)元素②、⑥的气态氢化物的稳定性较强的是H2O(填化学式).