题目内容
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(OH﹣)>cCH3COO﹣)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3?H2O)>c(NH4+)>c(Cl﹣)>c(OH﹣)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: ![]() c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+)
【答案】C
【解析】解:A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合,反应后溶质为等浓度的醋酸和NaCl,钠离子和氯离子不水解,则c(Na+)=c(Cl﹣),溶液显示酸性,氢氧根离子浓度较小,则c(CH3COO﹣)>c(OH﹣),溶液中正确的离子浓度大小为:c(Na+)=c(Cl﹣)>c(CH3COO﹣)>c(OH﹣),故A错误;
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7),溶液呈碱性,说明一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3H2O),结合物料守恒可得c(NH4+)>c(Cl﹣)>c(NH3H2O),溶液中正确的离子浓度大小为:c(NH4+)>c(Cl﹣)>c(NH3H2O)>c(OH﹣),故B错误;
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合,根据物料守恒可得: ![]() c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3),故C正确;
c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3),故C正确;
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸),恰好反应生成NaHC2O4 , 根据电荷守恒可知:2c(C2O42﹣)+c(HC2O4﹣)+c(Cl﹣)+c(OH﹣)=c(Na+)+c(H+),故D错误;
故选C.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案【题目】下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
【答案】C
【解析】A.铜粉与氯化铁反应生成氯化亚铁和氯化铜,会引入新杂质,故A错误;B.二者均与Fe反应,不符合除杂的原则,不能除杂,故B错误;C.Al与NaOH溶液反应,而Fe不能,则加NaOH溶解后过滤可除杂,故C正确;D.二者均与BaCl2溶液反应,应加适量硫酸除杂,故D错误;故选C。
【题型】单选题
【结束】
19
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
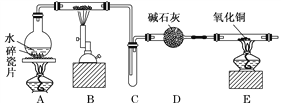
(1)A装置的作用是________________,B中反应的化学方程式为_____________。
(2)D的作用是____________________________________________________________。
(3)E中的现象是__________________________________________________________。
(4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。
