题目内容
7.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 各为0.1 mol的羟基(-OH)和OH-中含有的电子数目均为0.9NA | |
| B. | 标准状况下,22.4 L O2与44.8 L SO2充分反应后转移电子的数目为4NA | |
| C. | 各为0.1 mol的羟基(-OH)和OH-中含有的电子数目均为0.9NA | |
| D. | 1L 0.1 mol/L的NaClO溶液中含有的ClO-离子数目小于0.1NA |
分析 A、-OH不显电性;
B、氧气和二氧化硫的反应为可逆反应;
C、氢氧根含10个电子;
D、ClO-是弱酸根,在溶液中会水解;
解答 解:A、-OH不显电性,故1mol羟基中含9mol电子,故0.1mol羟基中含0.9mol电子即0.9NA个,但氢氧根含10个电子,即0.1mol氢氧根中含NA个电子,故A错误;
B、氧气和二氧化硫的反应为可逆反应,不能进行彻底,故注意的电子数小于4NA个,故B错误;
C、-OH不显电性,故1mol羟基中含9mol电子,故0.1mol羟基中含0.9mol电子即0.9NA个,但氢氧根含10个电子,即0.1mol氢氧根中含NA个电子,故C错误;
D、ClO-是弱酸根,在溶液中会水解,故溶液中ClO-的个数小于0.1NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
19.如图是研究二氧化硫性质的微型实验装置(实验时用另一表面皿扣在上面),现用75%硫酸溶液和亚硫酸钠晶体反应制取SO2气体并进行实验,实验现象很明显.下列说法中错误的是( )


| A. | 品红溶液褪色 | B. | 紫色石蕊溶液先变红后褪色 | ||
| C. | 酸性KMnO4溶液紫色褪去 | D. | 含酚酞的NaOH溶液红色变浅 |
20.下列叙述正确的是( )
| A. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| B. | 除去NaCl中少量的KNO3,可将固体混合物制成热饱和溶液,冷却结晶、过滤 | |
| C. | 将硫代硫酸钠溶液和稀硫酸混合,可通过观察产生气泡的快慢来判断化学反应速率 | |
| D. | 将铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色沉淀 |
17.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、NO3-、Fe2+、NH4+ | B. | Ag+、NO3-、Cl-、OH- | ||
| C. | K+、Ba2+、OH-、H+ | D. | NH4+、Br-、OH-、Mg2+ |
12.NaHCO3、Na2CO3、NaOH的混合物与200mL物质的量浓度为1mol/L的盐酸恰好完全反应,蒸干溶液,最终得到的固体质量为( )
| A. | 8g | B. | 15.5g | C. | 11.7g | D. | 无法计算 |
19.下列有关物理量相应的单位表达错误的是( )
| A. | 摩尔质量g/mol | B. | 气体摩尔体积mol/L | ||
| C. | 阿伏伽德罗常数/mol | D. | 密度g/cm3 |
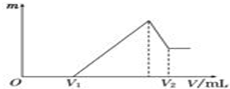 将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL,2mol/L H2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: