题目内容
17.有A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次增大.将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀.请回答下列问题:(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是D.
A.Na+ B.Mg2+ C.Cu2+ D.Ag+
(2)三种盐的化学式分别是AFeCl3,BAgNO3,CK2SO4.
(3)不需要加入任何试剂就能将上述三种盐溶液区分开来,鉴别出来的先后顺序为FeCl3、AgNO3、K2SO4(填化学式).
(4)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、SO42-、NO3-、K+四种离子且物质的量之比依次为1:2:3:4,则A、B、C三种盐的物质的量之比为1:3:2,若向溶液中加入过量Ba(OH)2,发生反应的总离子方程式为Fe3++2SO42-+2Ba2++3OH-=2BaSO4↓+Fe(OH)3↓.
分析 等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸银,C为硫酸盐;等物质的量混合,生成沉淀可能为AgCl,则A为FeCl3,B为AgNO3,C为K2SO4,以此来解答.
解答 解:(1)所给离子中只有Ag+和SO42-、NO3-、Cl-三种阴离子中Cl-按1:1生成沉淀,其余所给阳离子均和三种阴离子不沉淀,则该离子是Ag+,
故答案为:D;
(2)由上述分析可知,A为FeCl3,B为AgNO3,C为K2SO4,故答案为:FeCl3;AgNO3;K2SO4;
(3)观察黄色的溶液为FeCl3,与FeCl3反应生成白色沉淀的为AgNO3,最后可知K2SO4,则检验顺序为FeCl3、AgNO3、K2SO4,故答案为:FeCl3、AgNO3、K2SO4;
(4)Fe3+、SO42-、NO3-、K+四种离子且物质的量之比依次为1:2:3:4,设FeCl3为1mol,则AgNO3为3mol,K2SO4为2mol,A、B、C三种正盐的物质的量之比为1:3:2,向溶液中加入过量Ba(OH)2,Ba2+和OH-是过量的,故应根据Fe3+和SO42-的量来确定消耗的Ba2+和OH-量,故离子方程式为:Fe3++2SO42-+2Ba2++3OH-=2BaSO4↓+Fe(OH)3↓,
故答案为:1:3:2;Fe3++2SO42-+2Ba2++3OH-=2BaSO4↓+Fe(OH)3↓.
点评 本题考查无机物的推断,为高频考点,把握三种阴离子的摩尔质量、生成AgCl的沉淀反应推断物质为解答的关键,侧重分析能力及推断能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 乙酸的分子式:C2H4O | B. | 苯的结构简式: | ||
| C. | H2O2的电子式: | D. | 乙醛分子的结构简式:CH3COH |
| A. |  | B. |  | C. | 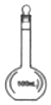 | D. |  |
| A. | 23 g钠的原子最外层电子数为2NA | |
| B. | 1 L 0.1 mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 标准状况下,22.4 L乙烷的分子数为NA | |
| D. | 1 mol甲基所含质子数为10NA |
| A. | 氧化性:A2>B2>C2>D2 | B. | D-不能被B2氧化 | ||
| C. | 氧化能力:B2>C2>D2 | D. | 还原性:A->B- |
 某初级中学学生发现实验室里有一瓶标签破损的无色溶液 (如图所示),于是在老师的指导下进行如下探究.
某初级中学学生发现实验室里有一瓶标签破损的无色溶液 (如图所示),于是在老师的指导下进行如下探究. 在一容积为2L的密闭容器中,加入一定量的N2和H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3△H<0,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入一定量的N2和H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3△H<0,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题: +CO2+H2O→
+CO2+H2O→ +NaHCO3;
+NaHCO3; +2H2O.
+2H2O.