题目内容
12.下表是元素周期表的一部分.表中所列的数分别代表某一种化学元素.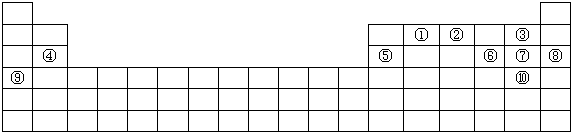
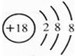
(1)表中①-⑩化学性质最不活泼的元素,其原子结构示意图为
 .
.(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(4)③、⑦、⑩的氢化物沸点最低的是HCl(填化学式).③元素与⑩元素两者核电荷数之差是26
(5)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表.可供选择的试剂:氯水、溴水、酒精、淀粉、CCl4、NaCl溶液、NaBr溶液.
| 实验步骤 | 实验现象与结论 |
分析 根据元素在周期表中的位置知,①~⑩分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br元素,
(1)表中①-⑩化学性质最不活泼的元素为稀有气体;
(2)表中能形成两性氢氧化物的元素是Al元素,⑨最高价氧化物的水化物是KOH,铝和KOH溶液反应生成偏铝酸钾和氢气;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(4)氢化物属于分子晶体,分子晶体熔沸点与其相对分子质量成正比,含有氢键的物质熔沸点较高;③、⑩元素核电荷数分别是9、35;
(5)氧化剂的氧化性大于氧化产物的氧化性,根据非金属元素单质之间的置换反应判断单质氧化性强弱.
解答 解:根据元素在周期表中的位置知,①~⑩分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br元素,
(1)表中①-⑩化学性质最不活泼的元素为稀有气体,为Ar元素,Ar原子核外有3个电子层、最外层电子数是8,其原子结构示意图为 ,
,
故答案为: ;
;
(2)表中能形成两性氢氧化物的元素是Al元素,⑨最高价氧化物的水化物是KOH,铝和KOH溶液反应生成偏铝酸钾和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Al;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,这几种元素非金属性最强的是Cl元素,则最高价氧化物的水化物酸性最强的是HClO4,
故答案为:HClO4;
(4)氢化物属于分子晶体,分子晶体熔沸点与其相对分子质量成正比,含有氢键的物质熔沸点较高,HF中含有氢键,HCl相对分子质量小于HBr,所以熔沸点最低的是HCl;
③、⑩元素核电荷数分别是9、35,二者核电荷数之差为26,
故答案为:HCl;26;
(5)氧化剂的氧化性大于氧化产物的氧化性,根据非金属元素单质之间的置换反应判断单质氧化性强弱,只要氯气能置换出溴化钠中溴,就说明氧化性氯气>溴,
其操作步骤及实验现象为
| 验步骤 | 实验现象与结论 |
| 试管中加入1-2mLNaBr溶液,再加入少量氯水,并加适量四氯化碳振荡 | 试管中溶液分层,且下层为橙色, 氧化性:Cl2>Br2 |
| 实验步骤 | 实验现象与结论 |
| 试管中加入1-2mLNaBr溶液,再加入少量氯水,并加适量四氯化碳振荡 | 试管中溶液分层,且下层为橙色, 氧化性:Cl2>Br2 |
点评 本题考查元素周期表和元素周期律及实验方案设计,侧重考查元素周期律、原子结构及物质性质,难点是性质实验方案设计,要根据实验目的、操作步骤及方法设计实验,注意化学用语的正确运用,题目难度不大.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案| A. | 18O、19O、24Mg | B. | 12C、31P、27Al | C. | 第ⅤA族原子 | D. | 第三周期原子 |
| A. | A3BC4 | B. | A2(BC4)3 | C. | A2BC3 | D. | A2BC4 |
| A. | 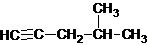 2-甲基-4-戊炔 2-甲基-4-戊炔 | |
| B. | CH2=C(C2H5)22-乙基-1-丁烯 | |
| C. | CH3CH(CH3)CH2CH(C2H5)CH3 2-甲基-4-乙基戊烷 | |
| D. | 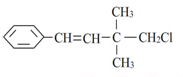 1,3,5-三硝基甲苯 1,3,5-三硝基甲苯 |
(1)溴的基态原子的价电子排布图为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘(I).
| 元素名称 | 氟 | 氧 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
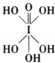 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于溶液中发生下列反应:I-+I2═I3-.I3-的中心原子周围的σ键电子对对数为2,孤电子对对数为3.
(6)写出一个CO2的等电子体:CS2、N2O.
| A. | 0.1mol•L-1的Na2S溶液:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) | |
| B. | 常温下,pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1的NH4NO3溶液:c(NH4+)=c(NO3-) | |
| D. | 常温下,pH=3的H2SO3溶液:c(H+)=c(HSO3-)=1×10-5mol•L-1 |
 .
. ;一种由B、C组成的化合物与AC2电子总数相等,其化学式为N2O.
;一种由B、C组成的化合物与AC2电子总数相等,其化学式为N2O.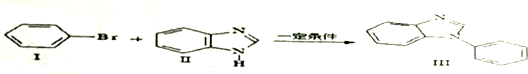
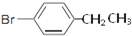 、
、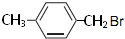 .
.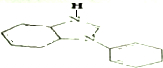 .
.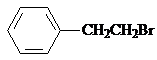 ,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为:
,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为: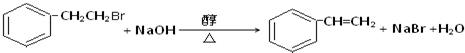 .
.