题目内容
15.下列化合物中含有手性碳原子的是( )| A. | CCl2F2 | B. | CH3-CHCl-COOH | C. | CH3CH2OH | D. | CH2Cl-OH |
分析 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,根据碳原子连接的原子或原子团分析判断.
解答 解:A.CCl2F2中碳原子连接2个相同的原子,所以化合物中不含有手性碳原子,故A错误;
B.CH3-CHCl-COOH中次甲基中碳原子上连接4个不同的原子或原子团,所以化合物中含有手性碳原子,故B正确;
C.CH3CH2OH分子中每个碳原子都含有相同的原子,所以化合物中不含手性碳原子,故C错误;
D.CH2Cl-OH中碳原子连接2个相同的原子,所以化合物中不含有手性碳原子,故D错误;
故选B.
点评 本题考查了手性碳原子的判断,明确手性碳原子的概念是解本题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.常温下,饱和NaClO溶液的pH约为11.某消毒液的主要成分为NaClO,洁厕灵主要成分为HCl.下列解释相关事实的离子方程式中不合理的是( )
| A. | 该消毒液加白醋生成HClO,可增强消毒能力:H++ClO-═HClO | |
| B. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═ClO-+Cl-+H2O | |
| C. | 常温下,该消毒液的pH≈11,是因为:ClO-+H2O?HClO+OH- | |
| D. | 该消毒液与洁厕灵混用会引起中毒:2H++Cl-+ClO-═Cl2↑+H2O |
3.816O、818O、O2-、O2、O是( )
| A. | 氧元素的五种不同微粒 | B. | 五种氧元素 | ||
| C. | 氧的五种同元素异形体 | D. | 氧的五种同位素 |
10.下列说法正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,使有效碰撞次数增大 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂不影响反应活化能但能增大单位体积内活化分子数目,增大反应速率 |
20.关于CCl2F2(商品名称为氟利昂-12)的叙述正确的是( )
| A. | 有两种同分异构体 | B. | 是平面形分子 | ||
| C. | 只有一种结构 | D. | 有四种同分异构体 |
4.下列有机物分子在核磁共振谱中只给出一种信号的是( )
| A. | CH3CHO | B. | CH3CH3 | C. | HCOOH | D. | CH3COOCH3 |
5.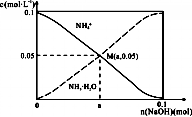 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 据电荷守恒可知在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 当n(NaOH)=0.1mol时,c(Na+)=c(NH4+)+c(NH3•H2O) | |
| D. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 |