题目内容
已知2Fe+3Br2=2FeBr3、2Fe3++2I-=2Fe2++I2.现将Fe(NO3)2溶液分别滴入到①H2SO4 ②HNO3 ③溴水 ④碘水等溶液中,其中能使Fe2+变成Fe3+的是( )
| A、①②③④ | B、只有②③ |
| C、②③④ | D、①②③ |
考点:铁盐和亚铁盐的相互转变
专题:元素及其化合物
分析:先根据反应方程式2Fe+3Br2=2FeBr3 2Fe3++2I-=2Fe2++I2 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,判断离子间的氧化性强弱,当离子的氧化性大于铁离子时,亚铁离子才能够被氧化成铁离子,注意在酸性条件下硝酸根离子检验氧化性,据此完成本题.
解答:
解:由题中反应方程式可知,离子的氧化性关系为:Br2>Fe3+>I2,HNO3>Fe3+,
①、Fe(NO3)2溶液滴入硫酸中,硝酸根离子在酸性条件下具有氧化性,能够将亚铁离子还原成铁离子,故①正确;
②Fe(NO3)2溶液滴入硝酸中,硝酸检验强氧化性,能发生反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故②正确;
③Fe(NO3)2溶液滴入溴水中,由于氧化性Br2>Fe3+,所以溴单质能够将亚铁离子氧化成铁离子,故③正确;
④Fe(NO3)2溶液滴入碘水中,由于氧化性Fe3+>I2,所以碘单质不能够氧化亚铁离子,故④错误;
故选D.
①、Fe(NO3)2溶液滴入硫酸中,硝酸根离子在酸性条件下具有氧化性,能够将亚铁离子还原成铁离子,故①正确;
②Fe(NO3)2溶液滴入硝酸中,硝酸检验强氧化性,能发生反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故②正确;
③Fe(NO3)2溶液滴入溴水中,由于氧化性Br2>Fe3+,所以溴单质能够将亚铁离子氧化成铁离子,故③正确;
④Fe(NO3)2溶液滴入碘水中,由于氧化性Fe3+>I2,所以碘单质不能够氧化亚铁离子,故④错误;
故选D.
点评:本题考查了铁盐与亚铁盐的相互转变、氧化还原反应中氧化性强弱比较等知识,题目难度不大,注意硝酸根离子在酸性条件下具有强氧化性,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,下列物质不能满足上述结果的是( )
| A、CH3COOH |
| B、C12H22O11 |
| C、C6H12O6 |
| D、CO与H2以任意比例混合 |
不能由单质直接化合而得到的化合物是( )
| A、FeCl3 |
| B、SO2 |
| C、NO2 |
| D、FeS |
在盐酸滴定NaOH溶液的实验中,以酚酞试液作指示剂,滴定到终点时颜色变化是( )
| A、由无色变红色 |
| B、由红色变无色 |
| C、由红色变蓝色 |
| D、由蓝色变红色 |
下列说法正确的是( )
| A、向久置于空气中的FeCl2溶液中滴入KSCN,会产生Fe(SCN)3红色沉淀 |
| B、用PH试纸测定0.1mol/L NaClO和CH3COONa溶液的PH,来比较HClO和CH3COOH酸性强弱 |
| C、用滴定管和量筒分别量取一定量的溶液并俯视读数,数值一定偏大 |
| D、加热饱和NaAlO2溶液可得到NaAlO2固体 |
下列实验操作正确的是( )
| A、保存液溴时,上层用水液封并装在带橡胶塞的试剂瓶中 |
| B、在蒸发皿中加热Na2CO3?10H2O使其脱水 |
| C、用酸式滴定管量取6.55mL的KMnO4溶液 |
| D、用分液漏斗分离溴乙烷与氢氧化钠溶液发生反应后的生成物 |
下列物质中,常温下能反应产生气体的是( )
| A、浓硫酸和铜 |
| B、稀硫酸和铜 |
| C、浓硝酸和铁 |
| D、稀硫酸和铝 |
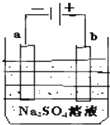 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液,下列实验现象中正确的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液,下列实验现象中正确的是( )| A、逸出气体的体积,a电极的小于b电极的 |
| B、有一电极逸出有刺激性气味的气体 |
| C、a电极附近呈红色,b电极附近呈蓝色 |
| D、a电极附近呈蓝色,b电极附近呈红色 |
下列物质中,能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
①SCN-;②Fe;③Fe2+;④Cu;⑤Zn;⑥OH-.
①SCN-;②Fe;③Fe2+;④Cu;⑤Zn;⑥OH-.
| A、①②③ | B、②④⑤ |
| C、①③⑥ | D、①②⑤ |