��Ŀ����
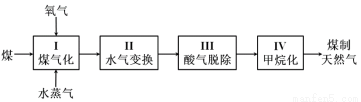
ú����Ȼ��������ú��Ч�ྻ���õ���;��֮һ���乤�����̼�ͼ���£�
��1����ӦI��C��s��+H2O��g�� CO��g��+H2��g����H=+135kJ��mol-1��ͨ����������벿��̼����ȼ�շ�Ӧ������������ת����ƽ���ƶ�ԭ��˵��ͨ�����������ã� ��
CO��g��+H2��g����H=+135kJ��mol-1��ͨ����������벿��̼����ȼ�շ�Ӧ������������ת����ƽ���ƶ�ԭ��˵��ͨ�����������ã� ��
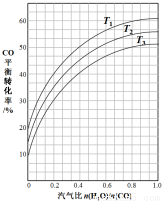
��2����ӦII��CO��g��+H2O��g�� CO2��g��+H2��g����H=?41kJ��mol-1����ͼ��ʾ��ͬ�¶������£�ú������ӦI������������ȣ�ˮ������ԭ������CO���ʵ���֮�ȣ���COƽ��ת���ʵı仯��ϵ��
CO2��g��+H2��g����H=?41kJ��mol-1����ͼ��ʾ��ͬ�¶������£�ú������ӦI������������ȣ�ˮ������ԭ������CO���ʵ���֮�ȣ���COƽ��ת���ʵı仯��ϵ��
���ж�T1��T2��T3�Ĵ�С��ϵ�� ��
����ú������ӦI�������������Ϊ0.8����ú������ӦI��ˮ���任��ӦII�õ�CO��H2�����ʵ���֮��Ϊ1:3����ӦIIӦѡ����¶��� ���T1����T2����T3������
��3���ټ��黯��ӦIV����֮ǰ��Ҫ�������ᷴӦIII��ú����ӦI��II��������к��������������壬�ֱ���H2S�� ��
�ڹ�ҵ�ϳ�����̼��ط��ѳ�H2S����õ�������ʽ�Σ��÷�Ӧ�Ļ�ѧ����ʽ�� ��
��4����֪��CO��g��+H2O��g�� CO2��g��+H2��g�� ∆H1��?41kJ��mol?1
CO2��g��+H2��g�� ∆H1��?41kJ��mol?1
2H2��g��+O2��g�� 2H2O��g�� ∆H2��?484kJ��mol?1
2H2O��g�� ∆H2��?484kJ��mol?1
CH4��g��+2O2��g�� CO2��g��+2H2O��g�� ∆H3��?802kJ��mol?1
CO2��g��+2H2O��g�� ∆H3��?802kJ��mol?1
��ӦIV��CO��g��+3H2��g�� CH4��g��+H2O��g�� ∆H�� ��
CH4��g��+H2O��g�� ∆H�� ��
 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д���100��ʱ����0.40 mol NO2�������2 L���ܱ������У��������·�Ӧ��2NO2��g��  N2O4��g�� ∆H < 0����ⷴӦ����������ݣ�
N2O4��g�� ∆H < 0����ⷴӦ����������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
����˵����ȷ����
A��0~20 s�ڣ�v��NO2�� = 0.005 mol��L-1.s-1
B��59 sʱ��c��NO2��һ������0.12 mol��L-1
C����������ʼʱ����NO2��������0.80 mol����÷�Ӧ��ƽ�ⳣ��K > 25/9
D����������Ӧ��120��ʱ���У���Ӧ��80 sʱ��n��N2O4�� < 0.08 mol


 ��Ӧ����ȡ����Ӧ����
��Ӧ����ȡ����Ӧ���� ����ķ�Ӧ
����ķ�Ӧ ����������ͭ������������Ũ����
����������ͭ������������Ũ����

