题目内容
20.A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
(1)若A、C均为化合物,E为白色沉淀,C为引起温室效应的主要气体,写出E可能的物质的化学式(写两种):Al(OH)3,H2SiO3.
(2)若A为短周期的金属单质,D为气态单质,C的溶液呈酸性或强碱性时,该反应都能进行.写出C溶液呈强碱性时反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;.
(3)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,
则该反应的化学方程式为:SO2+Cl2+2H2O═2HCl+H2SO4,
检验D中阴离子所用试剂为:AgNO3溶液,稀HNO3.
分析 A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,则B为H2O.
(1)若A、C均为化合物,C为引起温室效应的主要气体,判断C为CO2,为酸性强的制备酸性弱的反应,E为白色沉淀,判断E为Al(OH)3或H2SiO3,则A为偏铝酸盐或硅酸盐;
(2)若A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行,则A为Al,D为H2;
(3)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则A为Cl2,C为SO2,E为H2SO4,D为HCl.
解答 解:A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,判断为H2O;
(1)若A、C均为化合物,C为引起温室效应的主要气体,判断C为CO2,为酸性强的制备酸性弱的反应,E为白色沉淀,判断E为Al(OH)3或H2SiO3,则A为偏铝酸盐、硅酸盐,足量的C与A反应生成E的反应离子方程式为:SiO32-+2CO2+2H2O=2HCO3-+H2SiO3↓或 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:Al(OH)3、H2SiO3;
(2)若A为短周期的金属单质,D为气态单质,C溶液呈酸性或强碱性时,该反应都能进行,则A为Al,D为H2,该反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)常温下,若A为气态单质,C为非金属氧化物,A、C均能使品红溶液褪色,相对分子质量E>D,则A为Cl2,C为SO2,E为H2SO4,D为HCl,则反应的化学方程式为:SO2+Cl2+2H2O═2HCl+H2SO4,检验D中阴离子所用试剂为:AgNO3溶液,稀HNO3,
故答案为:SO2+Cl2+2H2O═2HCl+H2SO4;AgNO3溶液,稀HNO3.
点评 本题考查无机物推断,属于开放性题目,主要考查氯气、硫及其化合物、铝及其化合物等物质性质的推断和运用,题目难度中等.

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案| A. | 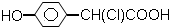 | B. | CH3CH (OH)-CH=CH-COOH | ||
| C. | CH3-CH=CH-COOH | D. | CH3CH(OH)CH2CHO |
| A. | D元素处于元素周期表中第3周期第Ⅳ族 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | B、D的最高价氧化物中,B、D与氧原子之间均为单键相连 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
| A. | 使用无毒无害的原料 | B. | 使用颜色为绿色的化工产品 | ||
| C. | 不使用任何化学物质 | D. | 使用不可再生的资源 |

| A. | 电池负极反应为:Zn-2e-═Zn2+ | B. | 锌是负极,碳棒是正极 | ||
| C. | 电子由碳棒经外电路流向锌 | D. | 锌锰干电池属一次电池 |
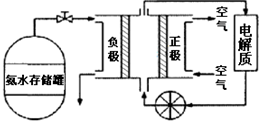
 .
.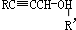
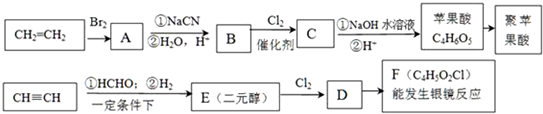
 .
.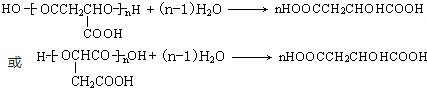 .
.