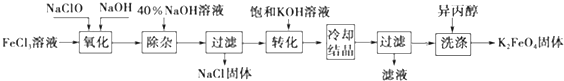
题目内容
14.下列说法正确的是( )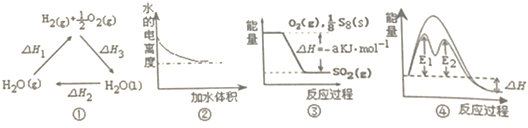
| A. | 图①中△H1=△H2+△H3 | |
| B. | 图②表示0.1mol•L-1氨水加水稀释过程中水的电离度变化曲线 | |
| C. | 图③可知S8燃烧的热化学方程式为S8(s)+8O2(g)=8SO2(g)△H=-8akJ•mol-1 | |
| D. | 图④在催化剂条件下,反应的活化能等于E1+E2 |
分析 A、根据盖斯定律来判断;
B、氨水稀释后氨水中氢氧根离子浓度较小,则水的电离程度逐渐变大;
C、根据反应物和产物的能量高低确定反应释放热量,根据热化学方程式的书写结合意义来回答;
D、催化剂可以降低反应的活化能,加快反应速率,但不会改变焓变,催化剂改变了反应历程,E1、E2分别代表各步反应的活化能.
解答 解:A、根据盖斯定律图①中-△H1=△H2+△H3,故A错误;
B、0.1mol•L-1氨水对水的电离抑制,加水稀释过程中,氨水中氢氧根离子浓度较小,则水的电离程度逐渐变大,故B错误;
C、根据反应物和产物的能量高低确定反应释放热量,根据图象内容得到S8燃烧的热化学方程式为S8(s)+8O2(g)=8SO2(g)△H=-8akJ•mol-1,故C正确;
D、E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故D错误.
故选C.
点评 本题考查学生反应热和焓变之间的关系、盖斯定律的理解、催化剂加快反应速率的实质以及弱碱的稀释等方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
4.传感器可以检测空气中SO2的含量,传感器工作原理如图所示.下列叙述正确的是( )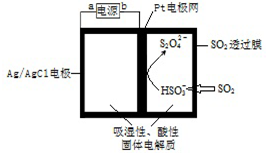

| A. | 阴极发生氧化反应 | |
| B. | 当电路中电子转移为5×10-5mol时,进入传感器的SO2为 1.12 mL | |
| C. | 正极反应式 Ag-e-=Ag+ | |
| D. | b为电源的负极 |
5.实验室常用下列反应制备S02:Na2S03+H2S04═Na2S04+H20+S02↑,该反应属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
2.2015年12约初华北大范围遭受今年以来最严重雾霾,环保监测中心研制中心研判,本次重污染与燃煤污染排放关系最为密切.开发新能源成为当前国际能源研究的重要课题.下列属于新能源的是( )
①天然气②生物质能③地热能④石油⑤太阳能⑥潮汐能⑦风能⑧氢能.
①天然气②生物质能③地热能④石油⑤太阳能⑥潮汐能⑦风能⑧氢能.
| A. | ①②③④ | B. | ②③⑤⑥⑦⑧ | C. | ④⑤⑥⑦⑧ | D. | ①②③⑤⑥⑦⑧ |
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使pH试纸显深蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、HCO3-、NO3- | |
| C. | pH=1的无色溶液中:K+、Fe3+、SO42-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- |
6.在一定温度下,下列叙述说明可逆反应A(g)+2B(g)?2C(g) 达到平衡的是( )
| A. | A、B、C的浓度之比为1:2:2 | |
| B. | 单位时间内消耗a molA,同时生成2a mol C | |
| C. | A的浓度不再变化 | |
| D. | 混合气体总物质的量为2a mol |
3.下列鉴别方法正确的是( )
| A. | 用澄清石灰水鉴别CO2和SO2 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用CO2鉴别Na[Al(OH)4]溶液和NaClO溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
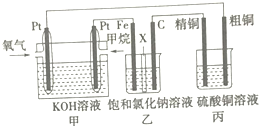 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题: