题目内容
【题目】汽车尾气的主要成分有CO、SO2、氮氧化物等,科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0KJ/mol
2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4KJ/mol
N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
请判断反应NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH4,在低温下能否自发进行,并说明理由______________________。
(2)已知TiO2催化尾气降解原理为:2CO(g)+O2(g) ![]() 2CO2(g); 2H2O(g)+4NO(g)+O2(g)
2CO2(g); 2H2O(g)+4NO(g)+O2(g) ![]() 4HNO3(g)。
4HNO3(g)。
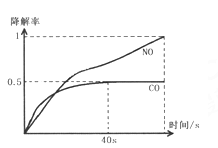
Ⅰ.在O2浓度几乎不变的条件下,模拟CO、NO的降解,得到降解率随时间变化如图1所示(![]() ),反应40秒后检测HNO3气体浓度有所降低,请用化学方程式结合化学反应原理知识解释出现该现象可能的原因_______________________。
),反应40秒后检测HNO3气体浓度有所降低,请用化学方程式结合化学反应原理知识解释出现该现象可能的原因_______________________。
Ⅱ.图2为在不同颗粒间隙的沥青混凝土(α、β型)和不同温度下,实验进行相同一段时间(t秒)后测得的CO降解率变化,回答谢列问题:
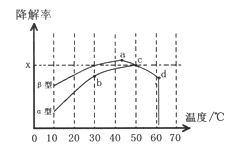
①已知50℃、t秒时容器中O2浓度为0.01mol/L,求此温度下CO降解反应的平衡常数_______。
②下列关于图2的叙述不正确的是_________
A.根据降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.a点的数据反映出CO与O2之间所发生的有效碰撞频率是整个实验过程中最高的
D.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10-60℃范围内进行实验,请在图2中用线段与阴影仿照“示例”描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(示例:![]() )。________________________
)。________________________
(3)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式_______。
【答案】 经计算ΔH4=(113.0-288.4)×0.5=-87.7KJ/mol<0,且可判断反应的ΔS<0,故在低温下可自发进行 40秒后发生反应2NO=N2+O2生成氮气,并且NO浓度降低,平衡2H2O+4NO+O2![]() 4HNO3逆向移动,造成HNO3浓度降低
4HNO3逆向移动,造成HNO3浓度降低 ![]() AC
AC  Ti-4e-+2H2O=TiO2+4H+
Ti-4e-+2H2O=TiO2+4H+
【解析】试题分析:(1)根据△H-T△S判断;Ⅰ. 40秒后发生反应2NO=N2+O2生成氮气,并且NO浓度降低;据此分析平衡移动;Ⅱ. ①根据平衡常数表达式计算;②根据影响反应速率和反应限度的因素分析;(3)阳极失电子发生氧化反应;
解析:(1)①2NO(g)+O2(g)=2NO2(g) ΔH1=-113.0kJ/mol
②2SO2(g)+O2(g)=2SO3(1) ΔH2=-288.4kJ/mol
根据盖斯定律②×![]() -①×
-①×![]() 得 NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH3=(113.0-288.4)×0.5=-87.7kJ/mol;气体物质的量减少,ΔS<0,ΔH<0,根据△H-T△S<0能自发进行,所以在低温下可自发进行;(2)Ⅰ.40秒后发生反应2NO=N2+O2生成氮气,并且NO浓度降低,NO浓度降低使平衡2H2O+4NO+O2
得 NO2(g)+SO2(g)=NO(g)+SO3(1) ΔH3=(113.0-288.4)×0.5=-87.7kJ/mol;气体物质的量减少,ΔS<0,ΔH<0,根据△H-T△S<0能自发进行,所以在低温下可自发进行;(2)Ⅰ.40秒后发生反应2NO=N2+O2生成氮气,并且NO浓度降低,NO浓度降低使平衡2H2O+4NO+O2![]() 4HNO3逆向移动,造成HNO3浓度降低;Ⅱ. ①设初始CO的浓度为a mol/L,
4HNO3逆向移动,造成HNO3浓度降低;Ⅱ. ①设初始CO的浓度为a mol/L,


![]() ;
;
②A.根据降解率由b点到c点随温度的升高而增大,b点不是平衡状态,故A错误;
B. 根据图示,相同温度下β型沥青混凝土反应速率快,故B正确;
C.温度越高,有效碰撞频率越高,故C错误;
D.在适宜的温度下催化剂的效果最好,故D正确;
③催化剂加快反应速率,所以10℃、t秒时就达到平衡,根据升高温度平衡转化率降低,可得图像如下
(3)以金属钛为阳极进行电解,阳极失电子发生氧化反应,生成TiO2,阳极的电极反应式为Ti-4e-+2H2O=TiO2+4H+。

【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
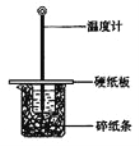
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热△H_____ (填“相等、不相等”)
(4)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,所求的中和热△H会 (填“偏大”、“偏小”、“无影响”) 若用KOH代替NaOH,实验所测的热量会_________________(填“偏大”、“偏小”、“无影响”)。
(5)他们记录的实验数据如下:
实验用品[ | 溶液温度 | 中和热 △H | |||
起始平 均温度 | 反应最高温度 | ||||
① | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL,0.55mol.L-1NaOH | 50mL,0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均视为1g·cm-3。
①根据上表数据计算中和热△H=__________(保留至小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)_______________。
A.实验装置保温、隔热效果差
B.量取稀盐酸溶液的体积时仰视读数
C.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度