题目内容
5.FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:(1)FeCl3 净水的原理是Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质.FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3.
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol•L-1,c(Fe3+)=1.0×10-3mol•L-1,
c(Cl-)=5.3×10-2mol•L-1,则该溶液的PH约为2.
②完成NaClO3 氧化FeCl2 的离子方程式:
□ClO3-+□Fe2++□H+=□Cl-+□Fe3++□H2O.
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O?Fe(OH)2++H+ K1
Fe(OH)2++H2O?Fe(OH)2++H+ K2
Fe(OH)++H2O?Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是K1>K2>K3.
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O?Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号)bd.
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氧化铁的关键条件是调节溶液的pH.
分析 (1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;钢铁设备中的Fe会与铁离子反应生成亚铁离子;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),据此溶液中氢离子的浓度,再根据pH=-lgc(H+)计算;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3;
(3)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小;控制条件使平衡正向移动,水解为吸热反应,所以降温平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,平衡正向移动;从反应的离子方程式中可知,氢离子的浓度影响高浓度聚合氯化铁的生成,所以关键步骤是调节溶液的pH.
解答 解:(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用;钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是:2Fe3++Fe=3Fe2+,
故答案为:Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质;2Fe3++Fe=3Fe2+;
(2)①根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,在这里可以忽略不计),则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2mol•L-1,则溶液pH=-lg1.0×10-2=2,
故答案为:2;
②氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3,配平后离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:1;6;6H+;1;6;3H2O;
(3)铁离子的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,则K1>K2>K3,控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故选bd;从反应的离子方程式中可知,氢离子的浓度影响高浓度聚合氯化铁的生成,所以关键步骤是调节溶液的pH,
故答案为:K1>K2>K3;bd;调节溶液的pH.
点评 本题考查铁的化合物性质的应用、氧化还原反应方程式的配平、对图象的分析能力、平衡移动影响因素等,需要学生具备扎实的基础与灵活运用难度,难度中等.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
| 实验序号 | ① | ② | ③ |
| 实验 内容 |  |  |  |
(1)在一周的观察过程中,他发现实验序号为①的试管中铁钉锈蚀速度最慢.
(2)实验②中发生的是吸氧腐蚀(填“析氢腐蚀”或“吸氧腐蚀”),溶液显碱性(填“酸”、“碱”或“中”),用相关电极方程式解释2H2O+O2+4e-=4OH-
(3)下列防止钢铁锈蚀的措施合理的是ac(填字母).
a.在自行车的钢圈表面镀镍
b.在地下钢铁管道上连接铜块
c.改变金属内部结构制成不锈钢.
| A. | 2-丙醇 | B. | 2,2-二甲基-1-丙醇 | ||
| C. | 2-甲基-2-丙醇 | D. | 氯乙烷 |
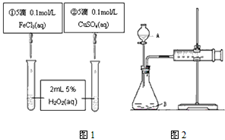 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.请回答下列问题
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.请回答下列问题
 .
. ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.

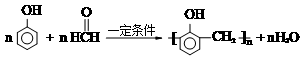 ,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.
,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.