题目内容
2.某离子反应的反应物和产物如下:MnO4-+I-+H+→Mn2++I2+IO3-+H2O(1)该反应中被还原的元素是Mn,氧化产物是I2、IO3-.
(2)如果该反应方程式中I2的化学计量数是3、IO3-的化学计量数是4,请配平上述反应并用单线桥法标出电子转移的方向和数目.6MnO4-+10I-+24H+═6Mn2++3I2+4IO3-+12H2O.
分析 (1)MnO4-+I-+H+→Mn2++I2+IO3-+H2O反应中,高锰酸根离子中锰元素化合价从+7价降为+2价,碘元素从碘离子中-1价部分升高到碘单质中的0价,部分升高到碘酸根离子中+5价的碘;
氧化还原反应中所含元素化合价降低的为氧化剂,反应中被还原,对应还原产物;
所含元素化合价升高的为还原剂,反应中被氧化,对应氧化产物;
(2)MnO4-+I-+H+→Mn2++I2+IO3-+H2O反应中,高锰酸根离子中锰元素化合价从+7价降为+2价,碘元素从碘离子中-1价部分升高到碘单质中的0价,部分升高到碘酸根离子中+5价的碘,依据氧化还原反应中得失电子守恒规律及原子个数守恒配平化学方程式,依据方程式判断转移电子数目,用单线桥表示.
解答 解:(1)MnO4-+I-+H+→Mn2++I2+IO3-+H2O反应中,高锰酸根离子中锰元素化合价从+7价降为+2价,碘元素从碘离子中-1价部分升高到碘单质中的0价,部分升高到碘酸根离子中+5价的碘;
氧化还原反应中所含元素化合价降低的为氧化剂,反应中被还原,对应还原产物,所以高锰酸钾为氧化剂,Mn被还原;
所含元素化合价升高的为还原剂,反应中被氧化,对应氧化产物,所以碘离子为还原剂,对应产物I2、IO3-,为氧化产物;
故答案为:Mn; I2、IO3-;
(2)MnO4-+I-+H+→Mn2++I2+IO3-+H2O反应中,高锰酸根离子中锰元素化合价从+7价降为+2价,碘元素从碘离子中-1价部分升高到碘单质中的0价,部分升高到碘酸根离子中+5价的碘,如果该反应方程式中I2的化学计量数是3、IO3-的化学计量数是4,则碘离子共失去30mol电子,依据得失电子守恒,高锰酸根离子系数为6,依据原子个数守恒方程式为:6MnO4-+10I-+24H+=6Mn2++3I2+4IO3-+12H2O,生成3mol碘转移30mole-,
用单线桥表示为: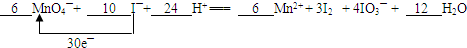 ;
;
故答案为:6;10;24;6;3;4;12;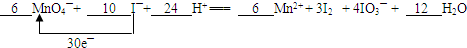 .
.
点评 本题考查了氧化还原反应方程式配平、氧化还原反应氧化剂、还原剂、氧化产物、还原产物的判断,单线桥表示,准确判断氧化还原反应中元素化合价变化是解题关键,注意单线桥表示的注意事项,题目难度不大.

| A. | 标准状态时,22.4L的CO2 | B. | 200g49%的H3PO4 | ||
| C. | 32g 的SO2气体 | D. | 3.01×1023个O2分子 |
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0,.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 步骤1: | 部分固体不溶 |
| 步骤2: | |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴适量H2O2,充分振荡后滴加KSCN. |
| A. | 2Na2O2+2CO2=2Na2CO3+O2 | |
| B. | Na2O2+MnO2=Na2MnO4 | |
| C. | 5Na2O2+2MnO4-+16H+=10Na++2Mn2++5O2↑+8H2O | |
| D. | 2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑ |
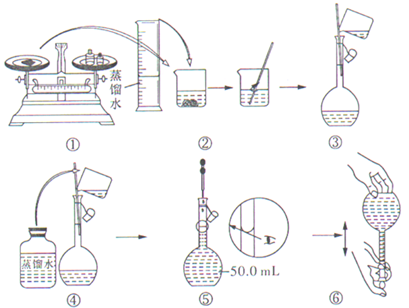
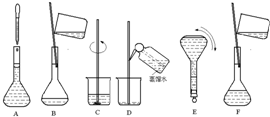 如图表示配制 100mL 0.100ol•L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
如图表示配制 100mL 0.100ol•L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: