题目内容
7. X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:(1)基态M2+的电子排布式为[Ar]3d9,X、Y、Z、M的电负性由大到小的顺序为O>N>B>Cu.
(2)化合物XCl3的中心原子杂化类型为sp2;YCl3的立体构型为三角锥形,XCl3、YCl3分子中属于非极性分子的是BCl3.
(3)H2Z、H2Z2、H2R的沸点分别为100℃、158℃,-60.4℃,试解释此种现象H2O2、H2O分子间可以形成氢键,H2O2相对分子质量最大,H2S分子间不能形成氢键.
(4)H2RO3的K1和K2分别为1.54×10-2和1.02×10-7,熔融化状态下RO3不能导电而Na2O能导电,请根据结构与性质的关系解释下列问题:
①K1>K2:SO32-与H+间的结合能力强于HSO3-与H+间的结合能力,故H2SO3比HSO3-更易电离出离子,电离程度大,对应K值大.
②RO3不能导电而Na2O能导电:SO3是共价化合物,属于非电解质,而Na2O是离子化合物.
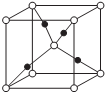
(5)Z、M形成的一种化合物晶胞如图所示:(实心球代表M)
①该化合物的化学式为Cu2O.
②若晶胞参数为apm.列式计算该晶胞的密度=$\frac{288}{{a}^{3}{N}_{A}×1{0}^{-30}}$g•cm-3.
分析 X、Y、Z、R、M是原子序数依次增大五种元素,M核外电子有29种运动状态,则M为Cu;基态X原子的s电子数比p电子数多3个,原子核外电子排布式为1s22s22p1,则X为B元素;在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,则Y处于Ⅱ族或ⅤA族,结合原子序数可知,若Y处于ⅡA族,R的原子序数大于Cu,不符合题意,故Y为N元素、Z为O元素、R为S元素.
(1)Cu处于第四周期IB族,Cu2+原子核外3d轨道有9个电子;非金属性越强,电负性越大;
(2)化合物BCl3中B原子孤电子对数=$\frac{3-1×3}{2}$=0,价层电子对数=3+0=3;NCl3中N原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,结合分子空间构型判断非极性分子;
(3)H2O2、H2O分子间可以形成氢键,H2O2相对分子质量最大,H2S分子间不能形成氢键;
(4)①SO32-与H+间的结合能力强于HSO3-与H+间的结合能力;
②SO3是共价化合物,属于非电解质,而Na2O是离子化合物;
(5)①Cu与O形成的化合物为Cu2O、CuO,根据均摊法计算晶胞中黑色球、白色球数目,进而确定化学式;
②结合分子中含有原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:X、Y、Z、R、M是原子序数依次增大五种元素,M核外电子有29种运动状态,则M为Cu;基态X原子的s电子数比p电子数多3个,原子核外电子排布式为1s22s22p1,则X为B元素;在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,则Y处于Ⅱ族或ⅤA族,结合原子序数可知,若Y处于ⅡA族,R的原子序数大于Cu,不符合题意,故Y为N元素、Z为O元素、R为S元素.
(1)Cu处于第四周期IB族,Cu2+原子核外3d轨道有9个电子,基态Cu2+的电子排布式为[Ar]3d9,
非金属性越强,电负性越大,故电负性:O>N>B>Cu,
故答案为:[Ar]3d9;O>N>B>Cu;
(2)化合物BCl3中B原子孤电子对数=$\frac{3-1×3}{2}$=0,价层电子对数=3+0=3,B原子采取sp2杂化,为平面正三角形结构,分子中正负电荷重心重合,属于非极性分子,
NCl3中N原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,为三角锥形结构,分子中正负电荷重心不重合,属于极性分子,
故答案为:sp2;三角锥形;BCl3;
(3)H2O2、H2O分子间可以形成氢键,H2O2相对分子质量最大,H2S分子间不能形成氢键,故过氧化氢的沸点最高,水次之,硫化氢的最低,
故答案为:H2O2、H2O分子间可以形成氢键,H2O2相对分子质量最大,H2S分子间不能形成氢键;
(4)①SO32-与H+间的结合能力强于HSO3-与H+间的结合能力,故H2SO3比HSO3-更易电离出离子,电离程度大,对应K值大,
故答案为:SO32-与H+间的结合能力强于HSO3-与H+间的结合能力,故H2SO3比HSO3-更易电离出离子,电离程度大,对应K值大;
②SO3是共价化合物,属于非电解质,而Na2O是离子化合物,熔融状态下可以导电,
故答案为:SO3是共价化合物,属于非电解质,而Na2O是离子化合物;
(5)①晶胞中黑色球为4、白色球数目为1+8×$\frac{1}{8}$=2,原子数目之比为2:1,故Cu、O形成的化合物为Cu2O,
故答案为:Cu2O;
②晶胞质量为2×$\frac{144}{{N}_{A}}$g,则晶胞密度为2×$\frac{144}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{288}{{a}^{3}{N}_{A}×1{0}^{-30}}$g•cm-3,
故答案为:$\frac{288}{{a}^{3}{N}_{A}×1{0}^{-30}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、杂化方式与空间构型、分子结构与性质、氢键、晶胞计算等,注意氢键对物质性质的影响.

 阅读快车系列答案
阅读快车系列答案| A. | 除去CO2中少量HCl气体:通过饱和NaHCO3溶液后再干燥气体 | |
| B. | 除去Na2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去氧化铝中混有的少量二氧化硅,用足量的稀盐酸溶解后过滤 | |
| D. | 除去FeCl3酸性溶液中少量的FeCl2:通入稍过量的Cl2 |
| A. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 | |
| B. | 麦芽糖和蔗糖互为同分异构体 | |
| C. | 淀粉遇碘化钾溶液变蓝 | |
| D. | 糖类不一定都能水解 |
| A. | CH3-CH=CH2和CH2=CH2的最简式相同 | |
| B. | 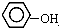 与 与 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
| A. | 加大CaCO3的量 | B. | 加大盐酸的浓度 | ||
| C. | 及时将产生的CO2导出 | D. | 减小CaCl2的浓度 |
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{3}$H | B. | O2和O3 | C. | 正丁烷和异丁烷 | D. | 乙烯和丙烯 |
 图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为O、Si(填元素符号).
图是部分主族元素第一电离能梯度图,图中a点对应的元素为氢,b、c两点对应的元素分别为O、Si(填元素符号).