题目内容
下列试剂中,可将乙醇、淀粉溶液和苯三种无色液体鉴别开的是( )
| A、氢氧化钠 |
| B、新制Cu(OH)2浊液 |
| C、溴水 |
| D、碘水 |
考点:有机物的鉴别
专题:有机反应
分析:乙醇、淀粉溶液、苯三种无色液体,与碘水混合时,乙醇与碘不反应,溶液不分层,淀粉溶液变蓝色,苯分层,以此来解答.
解答:
解:A.加入氢氧化钠,与乙醇、淀粉不反应,现象相同,不能鉴别,故A错误;
B.加入新制Cu(OH)2浊液,都不反应,不能鉴别乙醇、淀粉溶液,故B错误;
C.加入溴水,不能鉴别乙醇、淀粉溶液,故C错误;
D.加入碘水,乙醇与碘不反应,溶液不分层,淀粉溶液变蓝色,碘易溶于苯,溶液分层,可鉴别,故D正确.
故选D.
B.加入新制Cu(OH)2浊液,都不反应,不能鉴别乙醇、淀粉溶液,故B错误;
C.加入溴水,不能鉴别乙醇、淀粉溶液,故C错误;
D.加入碘水,乙醇与碘不反应,溶液不分层,淀粉溶液变蓝色,碘易溶于苯,溶液分层,可鉴别,故D正确.
故选D.
点评:本题考查有机物的鉴别,为高频考点,把握物质性质的差异为解答的关键,侧重醇、淀粉、苯性质的考查,注意相同现象不能鉴别物质,题目难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
某有机物的结构简式为: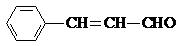 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )
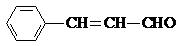 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )| A、1 mol该有机物发生银镜反应能生成 1 mol Ag |
| B、1 mol该有机物最多能够与6 mol H2 发生加成反应 |
C、它与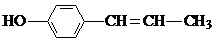 互为同分异构体 互为同分异构体 |
| D、该有机物能被酸性高锰酸钾溶液氧化 |
联合国环境规划署(UNEP)公布,2009年6月5日世界环境日纪念活动在墨西哥举行,环境日主题为“地球需要你:团结起来应对气候变化”.下列现象与气候变化有关的是( )
| A、酸雨 | B、光化学烟雾 |
| C、温室效应 | D、臭氧空洞 |
下列各组中的离子能在pH=1的无色溶液中大量共存的是( )
| A、Ba2+、Na+、I-、ClO- |
| B、Mg2+、Cl-、Al3+、NO3- |
| C、K+、Fe2+、Cl-、MnO4- |
| D、Ca2+、Na+、Fe3+、Br- |
取某一元醇12.5g,跟乙酸混合后,加入浓硫酸并加热,若反应完毕时,制得某酯11.17g,又回收该一元醇4.3g,则该一元醇为( )
| A、C5H11OH |
| B、C6H13OH |
| C、C7H15OH |
| D、C8H17OH |
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
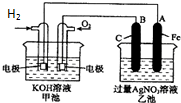 如图是一个化学过程的示意图.已知甲池的总反应式为:2H2+O2═2H2O
如图是一个化学过程的示意图.已知甲池的总反应式为:2H2+O2═2H2O