题目内容
3.过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等.试回答下列问题:(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:H2O2+2Fe2++2H+═2Fe3++2H2O.
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得.则上述最适合的过氧化物是BaO2.
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中,则该反应的化学方程式为Ca(OH)2+2HCHO+2H2O2=Ca(HCOO)2+4H2O,过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛利用率和产品的纯度.反应温度最好控制在30-70℃,温度不易过高,其主要原因是防止H2O2氧化和甲醛挥发.
分析 (1)酸性溶液中过氧化氢具有氧化性能氧化氯化亚铁为氯化铁,过氧化氢被还原为水;
(2)根据题目信息,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了沉淀;
(3)将氢氧化钙和甲醛溶液依次加入质量分数为30%~70%的过氧化氢溶液中,生成Ca(HCOO)2和H2O.
解答 解:(1)酸性条件下H2O2氧化氯化亚铁生成氯化铁和水,反应的离子方程式为:H2O2+2Fe2++2H+═2Fe3++2H2O;
故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2;
故答案为:BaO2;
(3)将氢氧化钙和甲醛溶液依次加入质量分数为30%~70%的过氧化氢溶液中,生成Ca(HCOO)2和H2O,其反应的方程式为:Ca(OH)2+2HCHO+2H2O2=Ca(HCOO)2+4H2O;过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛利用率和产品的纯度;反应温度最好控制在30-70℃,温度不易过高,其主要原因是防止H2O2氧化和甲醛挥发;
故答案为:Ca(OH)2+2HCHO+2H2O2=Ca(HCOO)2+4H2O;使甲醛充分氧化,提高甲醛利用率和产品的纯度;防止H2O2氧化和甲醛挥发.
点评 本题考查了氧化还原反应的产物判断、化学反应方程式的书写、物质性质的理解应用,侧重于考查学生的分析能力和对基础知识的应用能力,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
11.下列有机物中,含有两种官能团的是( )
| A. | CH3Cl | B. |  | C. | CH3CH2OH | D. | CH2=CHCl |
18.下列说法正确的是( )
| A. | 物质的量是一个基本物理量,表示物质所含粒子的多少 | |
| B. | 1mol氢中含有2mol氢原子和2mol电子 | |
| C. | 1molH2O的质量等于NA 个H2O 分子的质量总和 | |
| D. | 硫酸的摩尔质量是98g |
15.现有盐酸、NaCl溶液、NaOH溶液和新制氯水,可用来区别它们的试剂是( )
| A. | 酚酞试液 | B. | 紫色石蕊试液 | C. | AgNO3 溶液 | D. | NaHCO3溶液 |
12.某无色透明溶液中,能大量共存的离子组是( )
| A. | Na、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | NH4+、K+、Cl-、OH- | D. | Fe3+、K+、SCN-、Cl- |
13.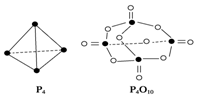 白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )
 白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6b+5d-4c-12a) kJ•mol-1 | B. | (4b+5d-4c-12a) kJ•mol-1 | ||
| C. | (4c+12a-4b-5d) kJ•mol-1 | D. | (4c+12a-6b-5d) kJ•mol-1 |
 Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1 有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体; A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.
有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体; A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色. .
.