题目内容
a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
(1)请用化学式填写a是 、b是 、c是 、d是
(2)写出a+c反应的离子方程式 .
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
(2)写出a+c反应的离子方程式
考点:物质的检验和鉴别的实验方案设计,离子方程式的书写
专题:离子反应专题
分析:AgNO3与其它三种物质反应均生成沉淀,则a为AgNO3,b与其它物质可生成沉淀、可生成气体,则b为HCl,所以d为Na2CO3,以此来解答.
解答:
解:(1)结合物质混合的现象及AgNO3与其它三种物质反应均生成沉淀,则a为AgNO3,b与其它物质可生成沉淀、可生成气体,则b为HCl,所以d为Na2CO3,则c为BaCl2,故答案为:AgNO3;HCl;BaCl2;Na2CO3;
(2)a+c反应生成AgCl沉淀和硝酸,离子反应为Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓.
(2)a+c反应生成AgCl沉淀和硝酸,离子反应为Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓.
点评:本题考查物质的检验和鉴别实验方案的设计,为高频考点,把握物质的性质及反应的现象为解答的关键,注意硝酸银的推断为解答的突破口,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某学生实验仪器的选择及数据记录,都合理的是( )
| A、酸碱中和滴定时,用10mL量筒量取10.00mL待测液 |
| B、用托盘天平称量25.20gNaCl固体 |
| C、常温条件下,用广泛pH试纸测得纯水的pH为7.0 |
| D、用500mL容量瓶配制480mL0.1000mol/LNaOH溶液 |
下列溶液中的氯离子的物质的量浓度与50mL 1mol?L-1的AlCl3溶液中氯离子物质的量浓度相等的是( )
| A、25mL 3 mol?L-1的KCl |
| B、75 mL 1.5 mol?L-1的CaCl2 |
| C、150 mL 1 mol?L-1的NaCl |
| D、100 mL 2 mol?L-1的FeCl3 |
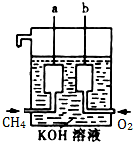 美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:
美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示: