题目内容
8.将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水蒸气,对于组成判断正确的是( )| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定有乙炔 | D. | 一定有乙烷 |
分析 标准状况下3.36LCO2的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为C1.5H4,由于是两种烃的混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,以此来解答.
解答 解:标况下3.36LCO2的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:$\frac{3.6g}{18g/mol}$=0.2mol,
则0.1mol两种气体烃组成的混合气完全燃烧及原子守恒可知,混合物的平均化学式为C1.5H4,
由于是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,可能含有乙烯、丙炔等,不含乙烷,
故选A.
点评 本题考查混合物的计算,为高频考点,把握烃燃烧的反应及原子守恒、平均值法为解答的关键,侧重分析与计算能力的考查,注意利用平均分子组成判断烃的组成,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列说法正确的是( )
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀硫酸>Fe3+ | |
| C. | 配制一定物质的量浓度溶液时发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
19.1L某溶液中含有的离子如下表:
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是( )
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 阳极生成1.5mol Cl2 | B. | a=3 | ||
| C. | 电解后溶液中c(H+)=1moL/L | D. | 阴极析出的金属是铜与铝 |
16.用NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 2.0 g D218O中含有的质子数为NA | |
| B. | 标准状况下,22.4 L NH3分子含有的杂化轨道数为4 NA | |
| C. | 78 g Na2O2晶体中所含阴、阳离子个数均为2 NA | |
| D. | 1 mol Fe完全溶于一定量的硝酸溶液中,转移的电子数一定是3 NA |
13.四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素Z位于周期表中第三周期VA族.
(2)Z、W形成的气态氢物的稳定性由强到弱顺序为H2S>PH3.(填化学式)
(3)XW2的化学式为CS2.
(4)Y的最高价氧化物的化学式为HNO3.
| X | Y | |
| Z | W |
(1)元素Z位于周期表中第三周期VA族.
(2)Z、W形成的气态氢物的稳定性由强到弱顺序为H2S>PH3.(填化学式)
(3)XW2的化学式为CS2.
(4)Y的最高价氧化物的化学式为HNO3.
17.下列有关实验的描述不正确的是( )
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 |
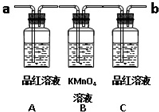 已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.
已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.