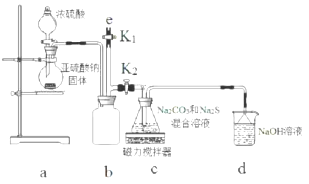
题目内容
20.下列实验操作或事故处理正确的是( )| A. | 金属钠着火,立即用水扑灭 | |
| B. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 实验结束后,用嘴吹灭酒精灯 |
分析 A、钠能和水剧烈反应;
B、浓硫酸稀释放热;
C、盐酸有强腐蚀性;
D、用嘴吹灭酒精灯容易引发火灾.
解答 解:A、钠能和水剧烈反应生成氢气,且反应放热,故能引起爆炸,故只能用沙土来灭,故A错误;
B、浓硫酸稀释放热,故为了防止溶液迸溅,只能将浓硫酸沿烧杯内壁注入水中,故B正确;
C、盐酸有强腐蚀性,且酸碱中和放热,会对皮肤造成二次伤害,故不能用盐酸洗,故C错误;
D、用嘴吹灭酒精灯容易引发火灾,应用灯帽盖灭,故D错误.
故选B.
点评 本题考查了常见实验操作和危险的处理,学会正确的实验操作能规避危险的发生,学会危险的正确处理能降低实验风险,应注重掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列试剂不能鉴别CO2和SO2的是( )
| A. | 澄清石灰水 | B. | 品红溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 溴水 |
11.下列元素中不属于主族元素的是( )
| A. | 磷 | B. | 铁 | C. | 碳 | D. | 氧 |
8.下列物质的保存方法正确的是( )
| A. | 用橡皮塞把液溴密封于玻璃瓶中 | |
| B. | 用磨口玻璃塞把氢氟酸密封于棕色试剂瓶中 | |
| C. | 把氯气加压液化后密封于钢瓶中 | |
| D. | 氯水通常保存于无色试剂瓶中 |
15.键能为破坏1mol化学键所需要吸收的能量或形成1mol化学键所放出的能量.已知H-H的键能为436kJ/mol,H-Cl的键能为432kJ/mol,氢气与氯气反应时放出热量.据此判断,下列说法不正确的是( )
| A. | H2分子比H原子更稳定 | |
| B. | 可求出Cl-Cl 的键能为428 kJ/mol | |
| C. | 1mol氢气与1mol氯气所含的总能量比2mol HCl所含的总能量高 | |
| D. | 理论上利用此反应制取盐酸的同时,可依据原电池原理获取电能 |
9.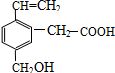 某有机物的结构为图所示,这种有机物具有的性质是( )
某有机物的结构为图所示,这种有机物具有的性质是( )
①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加聚反应.
 某有机物的结构为图所示,这种有机物具有的性质是( )
某有机物的结构为图所示,这种有机物具有的性质是( )①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加聚反应.
| A. | ①②④ | B. | ①②③④ | C. | ②③④⑤ | D. | ①②③④⑤ |
 化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数.
化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数.