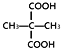
题目内容
【题目】烧杯中盛有100 mL1mol/L的NaHSO4溶液,向其中逐滴滴加1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )
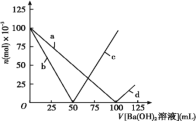
A.曲线d表示Na+的物质的量的变化
B.曲线c表示OH-的物质的量的变化
C.加入Ba(OH)2溶液50 mL反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.加入Ba(OH)2溶液大于50mL后,反应的离子方程式为:OH-+H+=H2O
【答案】B
【解析】
100mL0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,当氢氧化钡溶液体积小于50mL时,发生反应:2NaHSO4+ Ba(OH)2=BaSO4↓+2H2O+Na2SO4,当氢氧化钡溶液体积大于50mL后,硫酸氢钠中氢离子反应完全,再加入氢氧化钡溶液后发生反应:Na2SO4+ Ba(OH)2=BaSO4↓+2NaOH,直至Ba(OH)2溶液过量,硫酸根离子反应完全,据此进行解答。
A. 由图象曲线变化可知,在加入的氢氧化钡溶液体积小于100mL前,曲线a表示离子的浓度减小,此段曲线a表示的是硫酸根离子,当Ba(OH)2溶液体积大于100mL后,曲线d表示的是钡离子浓度,此反应过程中,Na+的物质的量始终未变,A项错误;
B. 由图可知c曲线表示50mLBa(OH)2溶液加入时为0,50mL以后,曲线c表示的离子浓度不断增大,则直线c表示OH的物质的量的变化,B项正确;
C. 加入Ba(OH)2溶液50mL,反应的化学方程式为:2NaHSO4+Ba(OH)2=BaSO4↓+2H2O+Na2SO4,离子方程式为:Ba2++2OH+2H++SO42=BaSO4↓+2H2O,C项错误;
D. 加入Ba(OH)2溶液大于50mL后,硫酸氢钠中氢离子已经反应完全,此时的反应为钡离子与硫酸根离子反应生成硫酸钡的反应,反应的离子方程式为:Ba2++SO42=BaSO4↓,D项错误;
答案选B。