题目内容
1.工业上为什么常用“H2O2”作氧化剂?分析 H2O2中氧是-1价具有极强的氧化性,而还原产生是水无污染,由此分析解答.
解答 解:因为双氧水有强氧化性 所以可以做常用的医用消毒剂 而还原产生是水,所以是绿色氧化剂,
故答案为:H2O2中氧是-1价具有极强的氧化性,而还原产生是水无污染.
点评 本题考查过氧化氢的性质,学生应结合过氧化氢中的氧元素是-1价,具有强氧化性,且还原产物是水无污染是绿色的氧化剂,比较容易.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.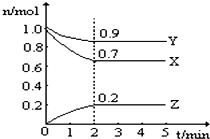 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为3X+Y?2Z
(2)从开始至2min,Z的平均反应速率为0.05mol/(L•min)
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
①该实验的目的是探究固体表面积、温度对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是Ⅱ和Ⅲ;
④请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:(1)该反应的化学方程式为3X+Y?2Z
(2)从开始至2min,Z的平均反应速率为0.05mol/(L•min)
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
②实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是Ⅱ和Ⅲ;
④请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
3.下列说法正确的是( )
| A. | 分子组成相差一个或几个“-CH2-”原子团的物质互为同系物,它们有相似的化学性质和不同的物理性质 | |
| B. | 甲烷是烷烃中碳的含量最低的,也是最简单的烃 | |
| C. | 不带支链的烃,其分子都是直线型的 | |
| D. | 常温时烷烃的同系物,只有四种呈气态 |
4.下列离子方程式书写不正确的是( )
| A. | Na2O2与H2O反应产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| B. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 向铜片中滴加浓硫酸并加热,有刺激性气味气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| D. | 向明矾溶液中滴入少量氢氧化钡溶液:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |