题目内容
将6molA和2molB在2L的密闭容器中混合并在一定条件下发生如下反应:3A(g)+B(S) 2C(g),ΔH<0,4s(秒)后反应达到平衡状态,此时测得C的浓度为1mol·L-1,下列说法中正确的是
2C(g),ΔH<0,4s(秒)后反应达到平衡状态,此时测得C的浓度为1mol·L-1,下列说法中正确的是
A.4s内用物质B表示的反应速率为0.125mol·L-1·S-1
B.达到平衡后若向容器中通入惰性气体,则A的转化率增大
C.此时,A、B、C的物质的量之比为3:1:2
D.达平衡后若升高温度,C的浓度将增大
C
【解析】
试题分析:A、B是固体,所以一般不用固体来表示反应速率,错误;B、达到平衡后若向容器中通入惰性气体,尽管压强增大,但反应体系中的各物质的浓度不变,所以平衡不移动,则A的转化率不变,错误;C、平衡时C的浓度是1mol/L,物质的量是2mol,则消耗A、B的物质的量分别是3mol、1mol,所以还余A、B的物质的量是3mol、1mol,所以此时,A、B、C的物质的量之比为3:1:2,正确;D、该反应是放热反应,升高温度,平衡逆向移动,所以C的浓度减小,错误,答案选C。
考点:考查反应速率的判断,平衡移动的判断

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
根据下列实验现象,所得结论错误的是

实验 | 实验现象 | 结论 |
A | Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 | 活动性:Al>Fe>Cu |
B | 试管中收集到无色气体 | 铜与浓硝酸反应产物是NO |
C | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D | 长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
 O,2Fe3++H2O2=2Fe2++O2↑+2H+ 下列说法正确的是
O,2Fe3++H2O2=2Fe2++O2↑+2H+ 下列说法正确的是

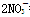 ===3Fe2++2NO↑+4H2O
===3Fe2++2NO↑+4H2O