题目内容
2.如图是元素周期表的部分框架,请回答:
(1)写出元素⑥在周期表中的位置第三周期第ⅣA族;元素⑦和元素⑧的最高价氧化物的水化物中酸性较强是H2SO4(用化学式表示).
(2)元素②与元素⑨形成的化合物属于共价(填“共价”或“离子”)化合物.
(3)请写出元素②的原子结构示意图为
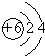 ;元素②的最高价氧化物结构式为:O=C=0;
;元素②的最高价氧化物结构式为:O=C=0;(4)元素①-④中的某单质在常温下化学性质稳定,通常可以做保护气,请用电子式表示其分子的形成过程2
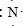 →
→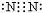 .
.(5)④⑦⑧三种元素形成的氢化物的稳定性由弱到强的是PH3<H2S<H2O
(6)③⑥⑦三种元素的原子半径由大到小的是Si>P>N.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Mg、⑥为Si、⑦为P、⑧为S、⑨为Cl.
(1)由元素位置可知,元素⑥处于周期表中第三周期第ⅣA族;元素非金属性越强,最高价含氧酸的酸性越强;
(2)元素②与元素⑨形成的化合物为CCl4;
(3)元素②为碳元素,原子核外有2个电子层,各层电子数为2、4;元素②的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对;
(4)氮气分子中氮原子之间形成三键,化学性质稳定,通常可以做保护气;
(5)元素非金属性越强,对应氢化物越稳定;
(6)同周期自左而右原子半径减小、同主族自上而下原子半径增大.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Mg、⑥为Si、⑦为P、⑧为S、⑨为Cl.
(1)由元素位置可知,元素⑥处于周期表中第三周期第ⅣA族;非金属性S>P,元素非金属性越强,最高价含氧酸的酸性越强,故H2SO4的酸性更强,故答案为:第三周期第ⅣA族;H2SO4;
(2)元素②与元素⑨形成的化合物为CCl4,属于共价化合物,故答案为:共价;
(3)元素②为碳元素,原子核外有2个电子层,各层电子数为2、4,原子结构示意图为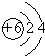 ;元素②的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对,结构式为O=C=O,
;元素②的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对,结构式为O=C=O,
故答案为: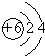 ;O=C=O;
;O=C=O;
(4)氮气分子中氮原子之间形成三键,化学性质稳定,通常可以做保护气,请用电子式表示其分子的形成过程为:2 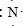 →
→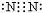 ,故答案为:2
,故答案为:2 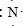 →
→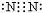 ;
;
(5)非金属性O>S>P,元素非金属性越强,对应氢化物越稳定,故氢化物稳定性:PH3<H2S<H2O,故答案为:PH3<H2S<H2O;
(6)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Si>P>N,故答案为:Si>P>N.
点评 本题考查元素周期表与元素周期律,比较基础,侧重对元素周期律的考查,注意理解用电子式表示物质或化学键的形成.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. |  | B. | 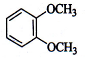 | C. | 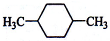 | D. |  |
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2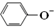 +H2O+CO2→2 +H2O+CO2→2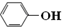 +CO32- +CO32- | |
| C. | 丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3$\stackrel{催化剂}{→}$  | |
| D. | 乙醛溶液与足量的银氨溶液共热的化学方程式:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O? |
| A. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| B. | 反应中I2为氧化剂,Cl2为氧化产物 | |
| C. | 生成1 mol Cl2时转移2 mol电子 | |
| D. | 由方程式可知还原性I2>Cl2 |
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |

(1)图1是锌锰干电池基本构造图,该电池的负极材料是Zn;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑;当电路中每通过0.2mole-,负极质量减少6.5g;
(2)图2是利用废旧锌锰干电池内的黑色糊状物分离得到黑色残渣MnO2的流程图.该流程中溶解和过滤操作均要使用到的玻璃仪器有烧杯和玻璃棒;
(3)图3是探究MnO2在制O2过程中的作用的实验装置图,利用该装置完成下表中实验一和实验二,实验过程中有关实验现象和所得数据如下表(已知:两次实验气体的体积在相同条件下测定:H2O2由分液漏斗滴入到圆底烧瓶).
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论 |
| 实验一 | 足量MnO2 | a.充分反应后未见黑色固体物质减少 b.收集到112mL气体 | ①催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | c.充分反应后黑色粉末部分溶解 d.收集到112mL气体 | ②氧化剂 |
④实验一、二中参加反应的H2O2的物质的量之比为2:1.
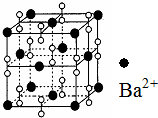 钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该氧化物的电子式为 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有6个 |