题目内容
【题目】某有机物A由C、H、O三种元素组成,相对分子质量为90。将9.0 g A完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g。A能与NaHCO3溶液发生反应,且2分子A之间脱水可生成六元环化合物。有关A的说法正确的是 ( )
A. 分子式是C3H8O3 B. A催化氧化的产物能发生银镜反应
C. 0.1 mol A与足量Na反应产生2.24 L H2(标准状况) D. A在一定条件下发生缩聚反应的产物是![]()
【答案】C
【解析】A.根据分析可知,该有机物的分子式为:C3H6O3,故A错误;B.由可与NaHCO3溶液发生反应可知A含羧基,再根据2分子A之间脱水可生成六元环化合物,可推出A还含羟基,因此A的结构简式为:CH3-CH(OH)-COOH,A中含羟基,可被催化氧化为醛基或羰基,含醛基的可发生银镜反应,而羰基不能发生银镜反应,故B错误;C.羟基和羧基均和钠反应,因此0.1molA与足量Na反应产生2.24 L H2(标准状况),故C正确;D.含有羧基、羟基,不含碳碳双键,则不能发生加聚反应,故D错误;故选C。

【题目】硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1)VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为_______。
(2)B、C、N三种元素第一电离能由小到大的顺序为________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF3 | BCl3 | BBr3 | BI3 | |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是__________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)==NH4[BF4] (s)能够发生的原因:____________。
制备环硼氨烷的方法如下:
![]()
BCl3、LiBH4中硼原子的杂化轨道类型依次为_________;与B3N3H6互为等电子体的分子的结构简式为________________。
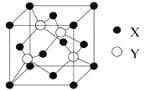
(4)立方氮化硼的熔点为3000℃,其晶胞结构如图所示,晶胞参数a=361.5pm。
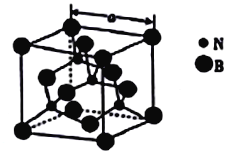
①立方氮化硼的晶体类型为_______________。
②紧邻的两个硼原子间的距离为_______(列出计算式即可) pm。
③立方氮化硼的密度为_____(列出计算式即可)g㎝-3。
【题目】I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O![]() CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
CO | H2O | CO2 | ||||
1 | 500 | 8 | 4 | 3.2 | 4 | |
2 | 700 | 4 | 2 | 0.8 | 3 | |
3 | 700 | 4 | 2 | 0.8 | 1 | |
(1)下列情况表明反应达到平衡状态的是________(填序号)
A. CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为__________。
(3)实验3和实验2相比,改变的条件是_____________。
II.(1)硫化钠溶液具有较强碱性,其原因是___________(用离子方程式表示)。
(2)欲使0.1mol的Na2S溶液中, 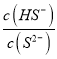 的值增大,可采取的措施是___________(填序号)
的值增大,可采取的措施是___________(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体