��Ŀ����
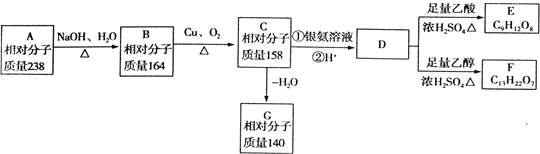
����Ŀ�����仯�����ڲ������졢�л��ϳɵȷ�����;�dz��㷺���ش��������⣺
(1)VB2��һ�ֵ����մɲ��ϣ���̬��ԭ�ӵļ۵����Ų�ͼΪ_______��
(2)B��C��N����Ԫ�ص�һ��������С�����˳��Ϊ________��
(3)���±�����ڹ�ҵ������Ҫ���ã��������±����ķе����±���ʾ��
BF3 | BCl3 | BBr3 | BI3 | |
�е�/K | 172 | 285 | 364 | 483 |
������±����е��������ߵ�ԭ����__________________��
����BF3���ӽṹ���ͷ�ӦBF3(g)+NH4F(s)==NH4[BF4] (s)�ܹ�������ԭ��____________��
�Ʊ�������ķ������£�
![]()
BCl3��LiBH4����ԭ�ӵ��ӻ������������Ϊ_________����B3N3H6��Ϊ�ȵ�����ķ��ӵĽṹ��ʽΪ________________��
(4)������������۵�Ϊ3000�棬�侧���ṹ��ͼ��ʾ����������a=361.5pm��
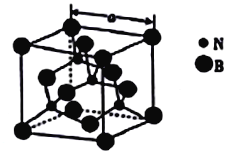
������������ľ�������Ϊ_______________��
�ڽ��ڵ�������ԭ�Ӽ�ľ���Ϊ_______(�г�����ʽ����) pm��
��������������ܶ�Ϊ_____(�г�����ʽ����)g�M-3��
���𰸡� 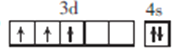 B<C<N ���ӽṹ���ƣ���Է������������Ӽ�����������ǿ BF3��������ԭ���пչ����F-�й¶Ե��ӣ���ͨ����λ���γ�BF4- sp2��sp3
B<C<N ���ӽṹ���ƣ���Է������������Ӽ�����������ǿ BF3��������ԭ���пչ����F-�й¶Ե��ӣ���ͨ����λ���γ�BF4- sp2��sp3 ![]() ԭ�Ӿ���
ԭ�Ӿ��� ![]() ��361.5
��361.5 ![]() ��107(������������)
��107(������������)
��������(1) V�ĺ˵����Ϊ23����۵����Ų�ʽΪ3d34s2�����̬��ԭ�ӵļ۵����Ų�ͼΪ![]() ��
��
(2)ͬһ����Ԫ�أ�Ԫ�صĵ�һ����������ԭ�����������������p���Ϊ������ṹ����VA���һ�����ܴ���������Ԫ�أ�B��C��NԪ�ش���ͬһ������ԭ������������N���ڵ�VA�壬��B��C��N����Ԫ�ص�һ��������С�����˳��ΪB<C<N��
(3)������±����ṹ�����Ҿ�Ϊ���Ӿ��壬��Է������������Ӽ�����������ǿ���ʷе��������ߣ�
���� BF3��������ԭ���пչ����F-�й¶Ե��ӣ���ͨ����λ���γ�BF4-����ӦBF3(g)+NH4F(s)=NH4[BF4] (s)�ܹ���������
��BCl3���ӵ�����ԭ��Bԭ���Ϻ���3���� ��������ԭ���ϵŵ��Ӷ���=![]() ����a-xb��=
����a-xb��=![]() ����3-3��1��=0������BCl3��������sp2�ӻ���LiBH4��Bԭ�ӵļ۲���Ӷ���Ϊ
����3-3��1��=0������BCl3��������sp2�ӻ���LiBH4��Bԭ�ӵļ۲���Ӷ���Ϊ![]() =4�������ӻ���ʽΪsp3�ӻ���C6H6��B3N3H6��Ϊ�ȵ����壬�����ӵĽṹ��ʽΪ
=4�������ӻ���ʽΪsp3�ӻ���C6H6��B3N3H6��Ϊ�ȵ����壬�����ӵĽṹ��ʽΪ![]() ��
��
(4)������������Ϊ���۵㣬ֻ���ڹ��ۼ���ӦΪԭ�Ӿ��壻
������ڵ�������ԭ�Ӽ�ľ���Ϊxpm����![]() xpm=361.5pm��x=
xpm=361.5pm��x=![]() ��361.5pm��
��361.5pm��
��һ�������������к���4��Nԭ�Ӻ�4��Bԭ�ӣ�һ�������е�����Ϊ![]() ��һ������������������ǣ�361.5pm��3�����������������ܶ���
��һ������������������ǣ�361.5pm��3�����������������ܶ���![]() gpm-3=
gpm-3=![]() ��107��
��107��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�