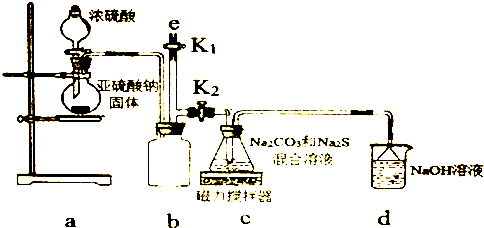
题目内容
5.节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )| A. | 为推广氢能的使用,工业上可采用电解水法制取大量氢气 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 将某些废旧塑料熔化后再成型 |
分析 A.用电解水法制取大量氢气需消耗大量电能;
B.将石油裂化、裂解,综合利用石油资源,符合“节能减排”;
C.有节制地开采煤、石油、天然气等矿物资源,化石能源使用时有污染物的排放;
D.将某些废旧塑料熔化后再成型,废物回收利用.
解答 解:A.电解水法制取大量氢气需要消耗大量的电能,与“节能减排”不相符,故A正确;
B.将石油裂化、裂解,综合利用石油资源,提高了能源利用率,减少化石能源的使用,符合“节能减排”,故B错误;
C.有节制地开采煤、石油、天然气等矿物资源,减少化石能源的使用,能减少污染物的排放,符合“节能减排”,故C错误;
D.将某些废旧塑料熔化后重新成型,固体的形状发生变化,废物回收利用,符合“节能减排”,故D错误;
故选A.
点评 本题考查“节能减排”,把握减少污染、减少能源使用为解答的关键,注重化学与生活、可持续发生的联系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol?L-1、0.001mol?L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol?L-1)的用量均为2mL.
(1)请完成以下实验设计表:
(2)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时)
计算用0.001 mol?L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率1×10-4mol•L-1•min-1(忽略混合前后溶液体积的变化).
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?否.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
(1)请完成以下实验设计表:
| 实验 编号 | T/K | 催化剂的 用量/g | KMnO4酸性溶液 的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
| KMnO4酸性溶液的浓度/mol.L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(3)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?否.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应.
17.下列物质不可能由醛与氢气发生加成反应得到的是( )
| A. | 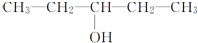 | B. | CH3-CH2-CH2-CH2OH | ||
| C. |  | D. | 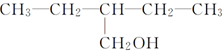 |
14.表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与水在一定条件下反应生成的物质C是乙醇(填名称);写出在一定条件下,A生成高分子化合物的化学方程式:nCH2=CH2$\stackrel{催化剂}{→}$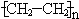 .
.
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤任何条件下不与氢气反应 ⑥可使酸性高锰酸钾溶液和溴水均褪色
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: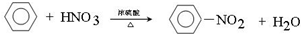 .
.
(4)写出由C氧化生成D的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为取代(酯化)反应;其化学方程式为:CH2=CH-COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH2=CH-COOC2H5+H2O.
| A | B | C | D | E |
| ①能使溴水褪色 ②比例模型为  ③能与水在一定条件下反应生成物质C | ①由C、H两 种元素组成 ②球棍模型为 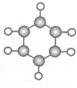 | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与E反应生成相对分子质量为100的酯 | ①相对分子质量 比物质C小2②能由物质C氧化而成 | ①由C、H、O三种元素组成 ②球棍模型为  |
(1)A与水在一定条件下反应生成的物质C是乙醇(填名称);写出在一定条件下,A生成高分子化合物的化学方程式:nCH2=CH2$\stackrel{催化剂}{→}$
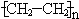 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤任何条件下不与氢气反应 ⑥可使酸性高锰酸钾溶液和溴水均褪色
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)写出由C氧化生成D的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为取代(酯化)反应;其化学方程式为:CH2=CH-COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH2=CH-COOC2H5+H2O.
 用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.
用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.