题目内容
(1)实验室需要配制0.3mol/L氢氧化钠溶液100mL,现有6mol/L的浓氢氧化钠溶液,计算所需浓氢氧化钠溶液的体积(mL);
(2)若用金属钠和水反应制得4g氢氧化钠,则同时可以生成标准状况下的气体多少L?
解:(1)设所需浓氢氧化钠溶液的体积为V,
溶液稀释前后溶质的物质的量不变,
则0.1L×0.3mol/L=V×6mol/L,
V=0.005L,即5ml,
答:所需浓氢氧化钠溶液的体积为5mL.
(2)n(NaOH)=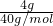 =0.1mol,
=0.1mol,
2Na+2H2O=2NaOH+H2↑
2mol 22.4L
0.1mol V
V=1.12L,
答:可以生成标准状况下的气体1.12L.
分析:(1)根据溶液稀释前后溶质的物质的量不变计算;
(2)根据反应的化学方程式计算.
点评:本题考查物质的量浓度以及化学方程式的计算,题目难度不大,注意溶液稀释前后溶质的物质的量不变的原则.
溶液稀释前后溶质的物质的量不变,
则0.1L×0.3mol/L=V×6mol/L,
V=0.005L,即5ml,
答:所需浓氢氧化钠溶液的体积为5mL.
(2)n(NaOH)=
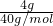 =0.1mol,
=0.1mol,2Na+2H2O=2NaOH+H2↑
2mol 22.4L
0.1mol V
V=1.12L,
答:可以生成标准状况下的气体1.12L.
分析:(1)根据溶液稀释前后溶质的物质的量不变计算;
(2)根据反应的化学方程式计算.
点评:本题考查物质的量浓度以及化学方程式的计算,题目难度不大,注意溶液稀释前后溶质的物质的量不变的原则.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目