题目内容
13.足量铜与一定量浓硝酸反应后过滤,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与3.36L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得溶液中加入1mol/L NaOH溶液至Cu2+恰好完全沉淀,将沉淀过滤、洗涤、干燥、灼烧后得到黑色固体,则所得黑色固体的质量是( )| A. | 12g | B. | 16g | C. | 24g | D. | 48g |
分析 足量Cu与一定浓硝酸反应生成硝酸铜与NO2、N2O4、NO的混合气体,硝酸没有剩余,混合气体与氧气混合通入水中又生成硝酸,纵观整个过程,Cu失去的电子等于氧气获得的电子,向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,由得失电子守恒可知,2Cu~~O2,由此分析解答.
解答 解:氧气的物质的量为:$\frac{3.36L}{22.4L/mol}$=0.15mol,由得失电子守恒可知,2Cu~~O2,所以n(Cu)=2×0.15mol=0.3mol,所以氧化铜的质量为:0.3mol×80g/mol=24g,故选C.
点评 本题考查混合物计算,难度中等,侧重考查学生的分析思维能力与解题方法技巧,注意利用守恒法进行解答.

练习册系列答案
相关题目
3.下列关于有机化合物的认识中,正确的是( )
| A. | 分子式为C4H10O的醇共有4种 | |
| B. | 包装用的材料聚乙烯和聚氯乙烯都属于烃 | |
| C. | 乙酸( CH3COOH)与油酸(C17H33COOH)互为同系物 | |
| D. | 淀粉、纤维素的分子式都是(C6H10O5)n,二者互为同分异构体 |
8.将含有氧化铁的铁片投入足量稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且溶液中的Fe2+与生成的H2的物质的量之比为5:2,则原混合物中氧化铁与铁的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:5 |
18. 三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.
三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.
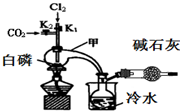
Ⅰ.白磷和Cl2化合制PCl3
已知白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3;POCl3能溶于PCl3.实验室制取PCl3的装置示意图和有关数据如下:
实验过程中要加入白磷、通入C02、通入Cl2、加热,实验时具体的操作顺序是:打开K2,使体系中充满CO2,再加入白磷,打开K1,通入氯气,再加热.
(1)干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(2)PCl3强烈水解的产物是H3PO3和HCl,PC13遇水所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)(己知亚磷酸H3PO3是二元弱酸:H3PO3?H++H2PO3-,H2PO3-?H++HPO32-).
(3)实验制得的粗产品中常含有POCl3、PC15等,PC15先用白磷除去后,再用C方法除去PC13中的POCl3制备纯净的PCl3.
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
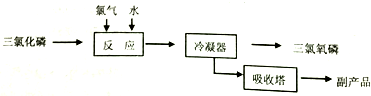
Ⅱ.氯化水解法生产POC13
主要反应是:PC13+C12+H20═POC13+2HCl,流程如下:
(1)若将0.01mol POCl3加到水中水解,再与含2.4gNa0H的溶液混合充分反应,并配成1L的溶液,取出少量的溶液于试管中,再向其中逐滴加入0.010mol/L的AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
(2)通过下列方法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
A.取ag产品于锥形瓶中,加入足量Na0H 溶液,再加稀硝酸至酸性.
B.向锥形瓶中加入0.1000mol/L的AgN03溶液40.00mL,使Cl-完全沉淀.
C.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖.
D.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积bmL.
己知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是B(填字母序号),滴定终点的现象为溶液由无色变为血红色,且30s不褪色.
A.FeCl2 B.NH4Fe(SO4)2 C.淀粉 D.甲基橙
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确.如无此操作,所测Cl元素含量将会偏小(填“偏大”、“偏小”或“不变”).
③根据上面实验数据计算三氯氧磷产品中Cl元素的含量为$\frac{35.5(4-bc)}{1000a}$.
 三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.
三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.Ⅰ.白磷和Cl2化合制PCl3
已知白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3;POCl3能溶于PCl3.实验室制取PCl3的装置示意图和有关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
(1)干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(2)PCl3强烈水解的产物是H3PO3和HCl,PC13遇水所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)(己知亚磷酸H3PO3是二元弱酸:H3PO3?H++H2PO3-,H2PO3-?H++HPO32-).
(3)实验制得的粗产品中常含有POCl3、PC15等,PC15先用白磷除去后,再用C方法除去PC13中的POCl3制备纯净的PCl3.
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
Ⅱ.氯化水解法生产POC13
主要反应是:PC13+C12+H20═POC13+2HCl,流程如下:

(1)若将0.01mol POCl3加到水中水解,再与含2.4gNa0H的溶液混合充分反应,并配成1L的溶液,取出少量的溶液于试管中,再向其中逐滴加入0.010mol/L的AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
(2)通过下列方法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
A.取ag产品于锥形瓶中,加入足量Na0H 溶液,再加稀硝酸至酸性.
B.向锥形瓶中加入0.1000mol/L的AgN03溶液40.00mL,使Cl-完全沉淀.
C.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖.
D.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积bmL.
己知:AgSCN是白色沉淀,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是B(填字母序号),滴定终点的现象为溶液由无色变为血红色,且30s不褪色.
A.FeCl2 B.NH4Fe(SO4)2 C.淀粉 D.甲基橙
②实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN而导致数据不准确.如无此操作,所测Cl元素含量将会偏小(填“偏大”、“偏小”或“不变”).
③根据上面实验数据计算三氯氧磷产品中Cl元素的含量为$\frac{35.5(4-bc)}{1000a}$.
5.物质的分类是化学研究的重要方法之一,近年来发现金星的大气层中含有三氧化二碳(C2O3),下列物质与它属于同一类别的是( )
| A. | H2O2、N2O4 | B. | 石墨、氧气 | C. | H2SO4、HClO | D. | NaCl、Na2CO3 |

 工业制得的纯碱中往往含有氯化钠杂质,为测定含NaC1杂质的样品中Na2CO3的质量分数,.他们采用如图所示装置,把一定质量的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.
工业制得的纯碱中往往含有氯化钠杂质,为测定含NaC1杂质的样品中Na2CO3的质量分数,.他们采用如图所示装置,把一定质量的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.