题目内容
15. (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.
请回答下列问题:
①高铁电池的负极材料是锌.
②放电时,正极发生还原(填“氧化”或“还原”)反应:已知负极反应为Zn-2e-+2OH-═Zn(OH)2,则正极反应为FeO42-+3e-+4H2O═Fe(OH)3+5OH-.
③放电时,正(填“正”或“负”)极附近溶液的碱性增强.
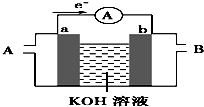
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极.
①使用时,空气从B口通入(填“A”或“B”);
②假设使用的“燃料”是甲烷,a极的电极反应式为CH4-8e-+10OH-═CO+7H2O;
?与铅蓄电池相比,当消耗相同质量的负极物质时,甲烷燃料电池的理论放电量是铅蓄电池的51.8倍(保留一位小数).
分析 (1)①放电时,该电池是原电池,原电池负极上失电子化合价升高而发生氧化反应;
②放电时,正极上得电子发生还原反应,总反应方程式减去负极电极反应式即得正极反应式;
③根据电极反应式确定碱性增强的电极;
(2)①由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气;
②假设使用的“燃料”是甲烷,则负极发生CH4-8e-+10OH-═CO+7H2O;
根据负极上的反应,消耗负极质量减少一样多时,转移得电子的物质的量即可;
解答 解:(1)①电池的负极上发生氧化反应,正极上发生还原反应.由高铁电池放电时总反应方程式可知,负极材料应为作还原剂的Zn,故答案为:锌;
②正极上得电子发生还原反应,由电池的总反应方程式-负极反应式=正极反应式可知,正极反应式为FeO42-+3e-+4H2O═Fe(OH)3+5OH-,
故答案为:还原;FeO42-+3e-+4H2O═Fe(OH)3+5OH-;
③放电时,负极电极反应式为Zn-2e-+2OH-═Zn(OH)2,正极反应式为FeO42-+3e-+4H2O═Fe(OH)3+5OH-,根据电极反应式知,正极上生成氢氧根离子导致溶液中氢氧根离子浓度增大,溶液的PH增大,
故答案为:正;
(2)①由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,故答案为:B;
②假设使用的“燃料”是甲烷,则负极发生CH4-8e-+10OH-═CO+7H2O,故答案为:②CH4-8e-+10OH-═CO+7H2O;
根据负极上的电极反应式:CH4-8e-+10OH-═CO+7H2O,消耗1g甲烷,转移电子的物质的量是$\frac{8}{16}$mol,铅蓄电池的负极上发生的反应为:Pb-2e-+SO42-=PbSO4,
消耗1gPb,转移电子的物质的量是$\frac{2}{207}$mol,所以当消耗相同质量的负极活性物质时,甲烷燃料电池的理论放电量是铅蓄电池的比值是$\frac{8}{16}$mol:$\frac{2}{207}$mol=51.8,故答案为:51.8.
点评 本题考查了原电池原理以及燃料电池的应用,根据元素化合价变化来确定正负极,在书写电池的电极方程式时要注意电解质对反应产物的影响,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| B. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| C. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 | |
| D. | 除去溴苯中少量的溴,可以加水后分液 |
 已知下表所示数据:
已知下表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
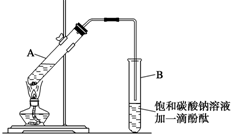
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管 5~10 min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30 mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL 乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀.
(2)导管不能插入到Na2CO3溶液中的原因是防止倒吸回流现象的发生.
(3)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
(5)充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯.分离出乙酸乙酯层后,可以用用B洗涤.
A.乙醇 B.饱和食盐水
C.碳酸钠溶液 D.NaOH溶液.
| A. | a+3b | B. | $\frac{a}{2}$+3b | C. | $\frac{a}{2}$+3b+$\frac{7w}{2}$ | D. | $\frac{a}{2}$+3b-$\frac{7w}{2}$ |
| A. | P4(白磷、s)+3O2(g)═2P2O3(s)△H=-1638 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol | |
| D. | H2(g)+1/2O2(g)═H2O(l)△H=-285.8 kJ/mol |
| A. | Zn与盐酸反应 | B. | CaO与H2O反应 | C. | NaOH与盐酸反应 | D. | C和H2O(g)反应 |
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$Na2CO3 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |