题目内容
 碘在科研与生活中有重要应用.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1 KI、0.2%淀粉溶液、0.20mol?L-1 K2S2O8、0.10mol?L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-═2SO42-+I2(慢)
I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变成为
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
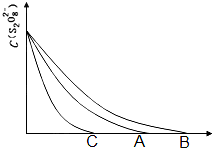
(3)已知图中A曲线为某条件下,浓度c(S2O82-)~反应时间t的变化曲线图,若保持其他条件不变,
考点:化学平衡的影响因素,化学平衡建立的过程,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据KI、Na2S2O3与淀粉的反应原理解答,注意反应过程的快慢问题;
(2)根据实验目的及表格数据分析,从而确定Vx的大小及理由,注意探究物质的量浓度对反应速率影响时,其它条件应相同;
(3)降低温度,化学反应速率减小,则到达平衡时间延长;加入催化剂,增大反应速率,则缩短反应到达平衡时间;
(2)根据实验目的及表格数据分析,从而确定Vx的大小及理由,注意探究物质的量浓度对反应速率影响时,其它条件应相同;
(3)降低温度,化学反应速率减小,则到达平衡时间延长;加入催化剂,增大反应速率,则缩短反应到达平衡时间;
解答:
解:(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,先发生S2O82-+2I-═2SO42-+I2(慢),后发生I2+2S2O32-═S4O62-+2I- (快),当S2O32-耗尽后,碘才能与淀粉作用显示蓝色,根据I2+2S2O32-═S4O62-+2I- (快)方程式知,I2与S2O32-的物质的量的关系为1:2,即1mol碘需2molS2O32-,根据方程式S2O82-+2I-═2SO42-+I2知,生成1mol碘需为1molS2O82-,即n(S2O32-):n(S2O82-)=2:1,为确保能观察到蓝色,碘需有剩余,即n(S2O32-):n(S2O82-)<2:1;
故答案为:蓝;<2;
(2)对照实验1和2发现,实验2取的0.20mol?L-1K2S2O8溶液的体积9mL,比实验1少了1mL,说明取的K2S2O8物质的量少,加水1mL,保证了溶液的体积不变,所以在其它条件不变的情况下,探究的是该反应速率与K2S2O8浓度的关系,同样原理对照实验1和3,为保证溶液的体积相同,须加2.0mL水,理由是保证其他条件不变,只改变反应物K2S2O8浓度,从而才到达对照实验目的,浓度越大反应速率越快,实验①K2S2O8溶液浓度最大,反应速率最快;
故答案为:2.0,①;
(3)保持其它条件不变,降低温度,反应速率降低,到达液颜色将由无色变成为蓝色的时间变长,B曲线符合;而使用催化剂,能加快化学反应速率,所以到达液颜色将由无色变成为蓝色的时间变短,C曲线符合;
故答案为:B,C;
故答案为:蓝;<2;
(2)对照实验1和2发现,实验2取的0.20mol?L-1K2S2O8溶液的体积9mL,比实验1少了1mL,说明取的K2S2O8物质的量少,加水1mL,保证了溶液的体积不变,所以在其它条件不变的情况下,探究的是该反应速率与K2S2O8浓度的关系,同样原理对照实验1和3,为保证溶液的体积相同,须加2.0mL水,理由是保证其他条件不变,只改变反应物K2S2O8浓度,从而才到达对照实验目的,浓度越大反应速率越快,实验①K2S2O8溶液浓度最大,反应速率最快;
故答案为:2.0,①;
(3)保持其它条件不变,降低温度,反应速率降低,到达液颜色将由无色变成为蓝色的时间变长,B曲线符合;而使用催化剂,能加快化学反应速率,所以到达液颜色将由无色变成为蓝色的时间变短,C曲线符合;
故答案为:B,C;
点评:本题考查了实验探究,注意探究外界条件对化学反应影响时,只能改变一个条件,其它条件必须相同,否则不能得出正确结论,难度较大

练习册系列答案
相关题目
等物质的量浓度的NaCl、MgCl2两种溶液的体积比为3:2,则两种溶液中Cl-的物质的量浓度之比为( )
| A、1:2 | B、3:4 |
| C、1:1 | D、3:2 |
下列物质互为同分异构体的是( )
A、
| ||||
| B、氧气和臭氧 | ||||
| C、甲烷和乙烷 | ||||
| D、正丁烷和异丁烷 |
不能用Cl2跟金属直接化合制取的是( )
| A、AlCl3 |
| B、FeCl2 |
| C、CuCl2 |
| D、NaCl. |
下列说法正确的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、放热反应在常温下一定很容易发生 |
| C、化学反应除了生成新的物质外,还伴随着能量的变化 |
| D、吸热反应不加热就不会发生 |
 A,B,C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
A,B,C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素,D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空: