题目内容
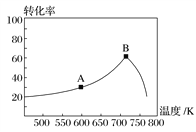
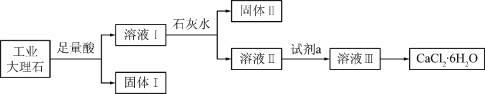
【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。将废旧锌锰电池回收处理后,将含MnO2、MnOOH、Zn(OH)2及少量Fe的废料进行回收处理,能实现资源的再生利用。用该废料制备Zn和MnO2的一种工艺流程如图:

已知:Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
回答下列问题:
(1)还原焙烧过程中,MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为_____。
(2)滤渣1主要成分的化学式是________。
(3)净化阶段
①为了除掉滤渣2中的元素,选择最佳的加入试剂为______(填序号)。
A.氯水 B.O2 C.氨水 D.MnCO3
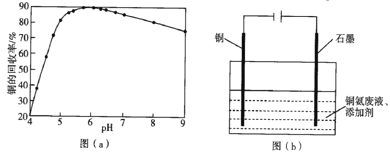
②已知:室温下,Ksp[Mn(OH)2]=10-13,Ksp[Fe(OH)3]=1×10-38,Ksp[Zn(OH)2]=10-17。净化时溶液中Mn2+、Zn2+的浓度约为0. 1mol·L-1,调节pH的合理范围是______。
(4)将MnO2和Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600C~750°C, 制取产品LiMn2O4。写出该反应的化学方程式:________。
(5)LiMn2O4材料常制作成可充电电池(如图),该电池的总反应为![]()
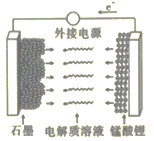
①充电时,锰酸锂为电池的_______(填“正极”“负极”“阴极”或“阳极”);该电极上发生的电极反应式为______________。
②该电池作为电源放电时,若电路中转移0.2mol e-,则石墨电极将减重____________。
【答案】2MnOOH+C![]() 2MnO+CO↑+H2O↑ C BD 3≤pH<5.5 8MnO2+2Li2CO3
2MnO+CO↑+H2O↑ C BD 3≤pH<5.5 8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑ 阳极 LiMn2O4-xe-== Li1-xMn2O4+xLi+ 1.4
4LiMn2O4+2CO2↑+O2↑ 阳极 LiMn2O4-xe-== Li1-xMn2O4+xLi+ 1.4
【解析】
含MnO2、MnOOH、Zn(OH)2及少量Fe的废料中加入过量炭黑,进行还原焙烧,生成CO、H2O、MnO、Fe、Zn等;再加入稀硫酸酸浸,滤渣1为C,滤液中含有FeSO4、ZnSO4、MnSO4等;净化时,需将Fe2+氧化为Fe3+,同时加入某试剂调节pH,将Fe3+转化为滤渣2,此时溶液中含有Mn2+和Zn2+;电解获得Zn和MnO2。
(1)还原焙烧过程中,MnOOH与炭黑反应,锰元素被还原为MnO,同时生成CO和水,该反应的化学方程式为2MnOOH+C![]() 2MnO+CO↑+H2O↑。答案为:2MnOOH+C
2MnO+CO↑+H2O↑。答案为:2MnOOH+C![]() 2MnO+CO↑+H2O↑;
2MnO+CO↑+H2O↑;
(2)焙烧所得固体中加入稀硫酸酸浸,只有炭黑不溶,所以滤渣1主要成分的化学式是C。答案为:C;
(3)①由以上分析知,滤渣2为Fe(OH)3,所以需加入氧化剂将Fe2+氧化为Fe3+,同时调节pH让其转化为沉淀,且尽可能不引入新的杂质,所以应选择最佳的加入试剂为BD。答案为:BD;
②当Fe3+完全转化为沉淀时,c(Fe3+)=1×10-5mol/L,利用Ksp[Fe(OH)3]=1×10-38,可求出pH=3;当净化时溶液中Mn2+、Zn2+的浓度约为0. 1mol·L-1,利用Ksp[Mn(OH)2]=10-13, Ksp[Zn(OH)2]=10-17,可求出pH=6、pH=8,由于pH高于5.5时Mn2+易被O2氧化,所以调节pH的合理范围是3≤pH<5.5。答案为:3≤pH<5.5;
(4)将MnO2和Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600C~750°C, 制取产品LiMn2O4,则MnO2作氧化剂,同时应生成O2和CO2,该反应的化学方程式:8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑。答案为:8MnO2+2Li2CO3
4LiMn2O4+2CO2↑+O2↑。答案为:8MnO2+2Li2CO3![]() 4LiMn2O4+2CO2↑+O2↑;
4LiMn2O4+2CO2↑+O2↑;
(5)①充电时,从电子流动的方向看,锰酸锂失电子,为电池的阳极;该电极上发生的电极反应式为LiMn2O4-xe-== Li1-xMn2O4+xLi+。答案为:LiMn2O4-xe-== Li1-xMn2O4+xLi+;
②该电池作为电源放电时,发生反应为LixC+xe-==xLi+C,利用Li进行计算,若电路中转移0.2mol e-,则生成Li0.2mol,则石墨电极将减重0.2mol×7g/mol=1.4g。答案为:1.4。