题目内容
6.表是元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题: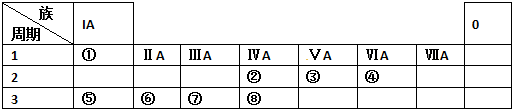
(1)①-⑧中金属性最强的元素是(元素符号)Na.
(2)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)Na>Al>O.
(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)HNO3>H2CO3>H2SiO3(或H4SiO4).
(4)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 由元素在周期表的位置可知,元素①-⑧分别为H、C、N、O、Na、Mg、Al、Si,
(1)同主族从上到下金属性减弱,同周期从左向右金属性减弱;
(2)电子层越多,原子半径越大;同周期从左向右原子半径减小;
(3)非金属性越强,最高价含氧酸的酸性越强;
(4)⑦单质与⑤的最高价氧化物的水化物反应,生成偏铝酸钠和氢气.
解答 解:由元素在周期表的位置可知,元素①-⑧分别为H、C、N、O、Na、Mg、Al、Si,
(1)短周期中Na的金属性最强,故答案为:Na;
(2)电子层越多,原子半径越大;同周期从左向右原子半径减小,则④、⑤、⑦的原子半径由大到小的顺序为Na>Al>O,故答案为:Na>Al>O;
(3)非金属性越强,最高价含氧酸的酸性越强,则②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3(或H4SiO4),
故答案为:HNO3>H2CO3>H2SiO3(或H4SiO4);
(4)⑦单质与⑤的最高价氧化物的水化物反应,生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
10.下列叙述正确的是( )
| A. | 1 mol H2O的质量为18g•mol-1 | |
| B. | 标准状况下,1 mol任何物质体积均为22.4L | |
| C. | 3.01×1023个NH3分子的质量为8.5g | |
| D. | CH4的摩尔质量为16g |
11.关于乙烯的化学性质,说法错误的是( )
| A. | 可与H2发生加成反应 | B. | 能使溴水褪色 | ||
| C. | 不能发生聚合反应 | D. | 可与酸性高锰酸钾发生氧化反应 |
8.下列物质中一氯代物有4种的是:( )
| A. |  | B. |  | C. |  | D. | CH3CH2CH(CH2CH3)2 |
1.绿色化学又称环境友好化学,它的主要特点之一是:提高原子的利用率,使原料中所有的原子全部转化到产品中,实现“零排放”.下列反应符合绿色化学这一特点的是( )
| A. | 工业冶铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| B. | 用生石灰制熟石灰CaO+H2O=Ca(OH)2 | |
| C. | 实验室制取二氧化碳CaCO3+2HCl=CaCl2+H2O+CO2↑ | |
| D. | 实验室制取氢气Zn+H2SO4=ZnSO4+H2↑ |
11.一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为55.2g,若其中水的质量为21.6g,则CO的质量为( )
| A. | 2.8g | B. | 4.4g | C. | 8.8g | D. | 4.4~8.8g |
 .
.
 .
.