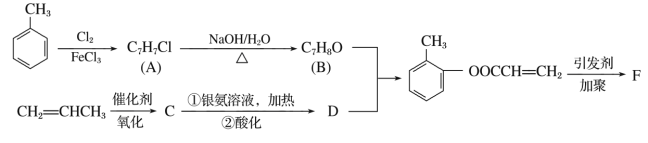
题目内容
【题目】已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )
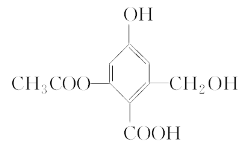
A. 1 mol X最多可与3 mol H2发生加成反应
B. X在一定条件下能与FeCl3溶液发生显色反应
C. X在一定条件下能发生消去反应和酯化反应
D. 1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗Na、NaOH、NaHCO3的物质的量分别为3 mol、4 mol、1 mol
【答案】C
【解析】
该物质中含有羧基、酯基、醇羟基和酚羟基、苯环,具有羧酸、酯、醇和酚、苯的性质,能发生酯化反应、中和反应、水解反应、取代反应、氧化反应、加成反应,以此解答该题。
A.含有苯环,可与氢气发生加成反应,1 mol X最多可与3 mol H2发生加成反应,选项A正确;
B.含酚-OH,则X在一定条件下能与FeCl3溶液发生显色反应,选项B正确;
C.含-OH、-COOH均可发生酯化反应,但该有机物不能发生消去反应,不符合消去反应的结构特点,选项C错误;
D.醇-OH、酚-OH、-COOH均与Na反应,只有-COOH与NaHCO3溶液反应,酚-OH、-COOH、-COOC-与NaOH反应,且酯水解生成的苯酚结构也与NaOH反应,则1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol,选项D正确.
答案选C。

【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
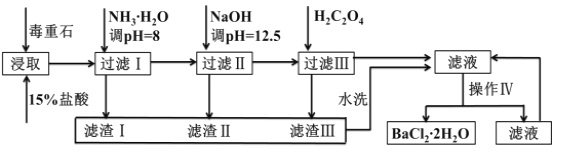
Ca2+ | Mg2+ | Fe3+ | ||
开始沉淀的pH | 11.9 | 9.1 | 1.9 | |
完全沉淀的pH | 13.9 | 11.1 | 3.2 | |
已知:室温条件下BaC2O4和CaC2O4均为沉淀,但BaC2O4的溶解度相对较大
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_____
a.容量瓶 b.量筒 c.烧杯d.滴定管
(2)为了加快毒重石的酸浸速率,可以采取的措施有________________________(至少两条)。
(3)加入氨水调节溶液pH=8的目的是__________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________________________。
(4)操作Ⅳ的步骤是:___________、___________、过滤。
【题目】汽车尾气中的主要污染物为NOx、CO等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。
I.催化剂存在时用H2将NO还原为N2。
已知: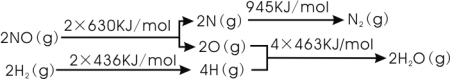
则H2还原NO生成氮气和水蒸气的热化学方程式是:______________________________。
II.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)![]() N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密闭器中加入足量的C与NO反应,所得实验数据如表
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
(1)写出该反应的平衡常数表达式________________________________________。
(2)结合表中数据,判断该反应的Q___0(填“>”或“<”),理由是________________________。.
(3)用电子式表示产物CO2的形成过程_________________________________________。
(4)判断该反应达到平衡的依据是____________
a.若容器内气体密度恒定,反应达到平衡状态
b.若容器内各气体浓度恒定,反应达到平衡状态
c.若容器内压强恒定,反应达到平衡状态
d.若2υ正(NO)=υ逆(N2),反应达到平衡状态
【题目】磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:
(1)磷原子的最外层电子排布式是__________,氧原子核外有______种不同运动状态的电子。C、O两种元素非金属性较强的是_______________。
(2)白磷在空气中露置时间长了会因温度达到____而自燃,使白磷升温的热量主要来自_________。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5,发生反应PCl5(g)![]() PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
(3)该反应的平衡常数表达式 K=_____________;
(4)其他条件不变,起始时向上述容器中充入1.0 mol PCl5,达到平衡时,PCl5的转化率____(选填“增大”、 “减小”“不变”),平衡常数 K____(选填“增大”、 “减小”“不变”)。
(5)在不同时间(t)测得反应过程中 PCl5 的部分数据如下:
t(s) | 0 | 50 | 100 | 250 | 350 |
n(mol) | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
则 100s 时, PCl3的物质的量浓度是__________________。