题目内容
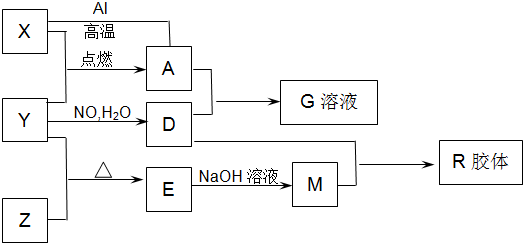
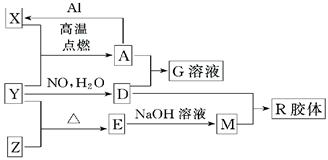
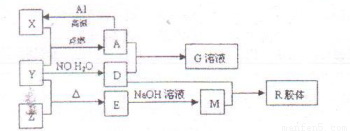
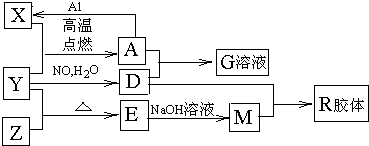
图中X、Y、Z为单质,其它为化合物,它们之间存在如图转化关系(部分产物已略去).其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应.

回答下列问题:
(1)组成单质Y的元素在周期表中的位置是
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为
 .
.
(3)已知A与1molAl反应转化为X时(所有物质均为固体).放出aKJ热量.写出该反应的热化学方程式:
(4)写出A和D的稀溶液反应生成G的离子方程式:

回答下列问题:
(1)组成单质Y的元素在周期表中的位置是
第二周期第VIA族
第二周期第VIA族
;M中存在的化学键类型为离子键、共价键
离子键、共价键
;R的化学式是H2SiO3(或H4SiO4)
H2SiO3(或H4SiO4)
.(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为


(3)已知A与1molAl反应转化为X时(所有物质均为固体).放出aKJ热量.写出该反应的热化学方程式:
8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol
8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol
.(4)写出A和D的稀溶液反应生成G的离子方程式:
3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
.分析:依据题干信息,结合转化关系和反应条件的分析推断得到:A俗称磁性氧化铁,即为四氧化三铁;能与氢氟酸反应且不溶于水的酸性氧化物是SiO2,即E为SiO2,根据框图中的转化关系,可知X为铁、Y为O2、Z为Si、D为硝酸、M为硅酸钠、G为硝酸铁,R为H2SiO3;
(1)根据原子核外电子排布来确定元素在周期表中的位置,根据物质中的成键元素确定物质中的化学键类型,
(2)根据电子式的书写方法和物质中化学键类型来解答;
(3)根据热化学方程式的含义和书写规则来分析;
(4)根据硝酸的强氧化性和四氧化三铁中的二价铁元素具有还原性的性质来书写;
(1)根据原子核外电子排布来确定元素在周期表中的位置,根据物质中的成键元素确定物质中的化学键类型,
(2)根据电子式的书写方法和物质中化学键类型来解答;
(3)根据热化学方程式的含义和书写规则来分析;
(4)根据硝酸的强氧化性和四氧化三铁中的二价铁元素具有还原性的性质来书写;
解答:解:A俗称磁性氧化铁,即为四氧化三铁;能与氢氟酸反应且不溶于水的酸性氧化物是SiO2,即E为SiO2,根据框图中的转化关系,可知X为铁、Y为O2、Z为Si、D为硝酸、M为硅酸钠、G为硝酸铁,R为H2SiO3;
(1)根据氧原子的核外电子排布,知氧元素在周期表的第二周期第VIA族;硅酸钠中有离子键、共价键;R的化学式是
H2SiO3(或H4SiO4);故答案为:第二周期第VIA族;离子键、共价键; H2SiO3(或H4SiO4);
(2)ZH4的分子式为SiH4,其电子式为: ,故答案为:
,故答案为: ;
;
(3)根据热化学方程式的书写方法和书写原则,反应的热化学方程式为8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol;
故答案为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol;
(4)四氧化三铁和硝酸反应是氧化物中的二价铁元素被氧化到最高价,硝酸中氮元素被还原到+2价,反应的离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
(1)根据氧原子的核外电子排布,知氧元素在周期表的第二周期第VIA族;硅酸钠中有离子键、共价键;R的化学式是
H2SiO3(或H4SiO4);故答案为:第二周期第VIA族;离子键、共价键; H2SiO3(或H4SiO4);
(2)ZH4的分子式为SiH4,其电子式为:
 ,故答案为:
,故答案为: ;
;(3)根据热化学方程式的书写方法和书写原则,反应的热化学方程式为8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol;
故答案为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s)△H=-8a kJ/mol;
(4)四氧化三铁和硝酸反应是氧化物中的二价铁元素被氧化到最高价,硝酸中氮元素被还原到+2价,反应的离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
点评:本题目是一道框图推断题,根据题干信息推出各种物质是答题的前提,然后结合所学知识来回答.

练习册系列答案
相关题目
 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O