题目内容
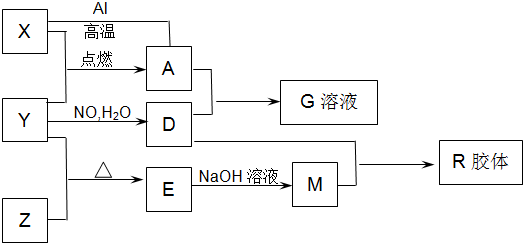
如图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去).其中,A俗称磁性氧化铁:E是不溶于水的酸性氧化物,能与氢氟酸反应.
回答下列问题:
(1)A的化学名称是 ;E的化学式 .
(2)知A与1molAl反应转化为X时(所有物质均为固体).放出aKJ热量.现有A 与Al的混合物共304g用于干焊接,恰好反应,则应放出 KJ热量.
(3)写出E和石灰石反应的化学方程式: .
(4)向D的稀溶液中,加入过量的X粉末,假设生成的气体只有一种,写出有关反应的化学方程式 .

回答下列问题:
(1)A的化学名称是
(2)知A与1molAl反应转化为X时(所有物质均为固体).放出aKJ热量.现有A 与Al的混合物共304g用于干焊接,恰好反应,则应放出
(3)写出E和石灰石反应的化学方程式:
(4)向D的稀溶液中,加入过量的X粉末,假设生成的气体只有一种,写出有关反应的化学方程式
分析:A俗称磁性氧化铁,则A是Fe3O4,E是不溶于水的酸性氧化物,能与氢氟酸反应,则E是SiO2,X和Z都能和Y反应,则Y是O2,X是Fe,Z是Si,氧气和一氧化氮、水反应生成硝酸,则D是HNO3,四氧化三铁和硝酸反应生成硝酸铁、一氧化氮和水,G是溶液,则G是Fe(NO3)3,二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,硅酸钠和硝酸反应生成硅酸胶体,注意M是Na2SiO3,R是H2SiO3,结合物质的性质分析解答.
解答:解:A俗称磁性氧化铁,则A是Fe3O4,E是不溶于水的酸性氧化物,能与氢氟酸反应,则E是SiO2,X和Z都能和Y反应,则Y是O2,X是Fe,Z是Si,氧气和一氧化氮、水反应生成硝酸,则D是HNO3,四氧化三铁和硝酸反应生成硝酸铁、一氧化氮和水,G是溶液,则G是Fe(NO3)3,二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,硅酸钠和硝酸反应生成硅酸胶体,注意M是Na2SiO3,R是H2SiO3,
(1)通过以上分析知,A是四氧化三铁,E是SiO2,
故答案为:四氧化三铁;SiO2;
(2)四氧化三铁和铝能发生铝热反应,反应方程式为:8Al+3Fe3O4
9Fe+4Al2O3,四氧化三铁与1molAl反应转化为X时,放出aKJ热量.四氧化三铁与Al的混合物共304g用于干焊接,恰好反应,设铝的物质的量为xmol,二者恰好反应,则四氧化三铁的物质的量是
mol,27x+232×
x=304,x=
,2.7mol完全反应放出的热量为=
akJ,
故答案为:
akJ;
(3)高温下,二氧化硅和碳酸钙反应生成硅酸钙和二氧化碳,反应方程式为:SiO2+CaCO3
CaSiO3+CO2↑,故答案为:SiO2+CaCO3
CaSiO3+CO2↑;
(4)过量铁和稀硝酸反应生成硝酸亚铁和一氧化氮,反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,故答案为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O.
(1)通过以上分析知,A是四氧化三铁,E是SiO2,
故答案为:四氧化三铁;SiO2;
(2)四氧化三铁和铝能发生铝热反应,反应方程式为:8Al+3Fe3O4
| ||
| 3x |
| 8 |
| 3 |
| 8 |
| 8 |
| 3 |
| 8 |
| 3 |
故答案为:
| 8 |
| 3 |
(3)高温下,二氧化硅和碳酸钙反应生成硅酸钙和二氧化碳,反应方程式为:SiO2+CaCO3
| ||
| ||
(4)过量铁和稀硝酸反应生成硝酸亚铁和一氧化氮,反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,故答案为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O.
点评:本题以铁和硅元素为载体考查了无机物的推断,以A、E的性质为突破口结合其它反应物及反应条件来进行分析解答,知道物质之间的转化,难度中等.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,若X原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,若X原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A、元素X位于元素周期表的第二周期第ⅣA族 | B、元素W在自然界以化合态的形式存在 | C、Z的单质能在X的单质(X2)中燃烧生成ZX3 | D、元素Y的最高正化合价与元素W的相同 |



 (2010?龙岩模拟)X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.
(2010?龙岩模拟)X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.
 A.该晶体属于分子晶体
A.该晶体属于分子晶体