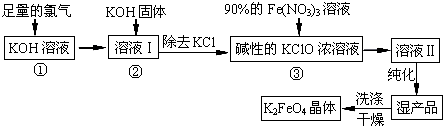
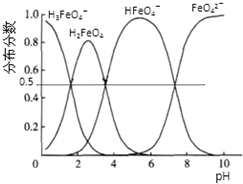
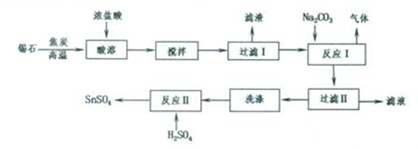
题目内容
16.能源的开发利用与人类社会的可持续发展息息相关.(1)已知:Fe203(s)+3C(s)═2Fe(s)+3C0(g)△H1=a kJ•mol-1
C0(g)+$\frac{1}{2}$02 (g)═C02 (g)△H2=ckJ•mol-1
4Fe(s)+302(g)═2Fe203 (s)△H3=c kJ•mol-1
则C的燃烧热△H=$\frac{2a+6b+c}{6}$kJ•mol-1.
(2)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是CD(填序号).
A.C(s )+C02 (g)═2C0(g)
B.Na0H(aq)+HCl(aq )═NaCl(aq)+H20(l)
C.2C0(g)+02 (g)═2C02 (g )
D.2H2(g)+O2(g)=2H2O(l)△H<0
(3)若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:CO-2e-+CO32-=2CO2 或H2-2e-=2H+.
分析 (1)三个热化学方程式依次编号为①、②、③,根据盖斯定律,(①×2+②×6+③)÷6得,C(s)+O2(g)═CO2(g)△H=$\frac{1}{6}$(2a+6b+c)kJ•mol-1,则C的燃烧热为$\frac{2a+6b+c}{6}$kJ•mol-1;
(2)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(3)以熔融的K2CO3与CO2为反应的环境,负极是失电子发生氧化反应的电极.
解答 解:已知:①Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=a kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=b kJ•mol-1
③4Fe(s)+3O2(g)═2Fe2O3(s)△H3=c kJ•mol-1
据盖斯定律,(①×2+②×6+③)÷6得:C(s)+O2(g)═CO2(g)△H=$\frac{1}{6}$(2a+6b+c)kJ•mol-1,则C的燃烧热为$\frac{2a+6b+c}{6}$kJ•mol-1,故答案为:$\frac{2a+6b+c}{6}$;
(2)能设计成原电池的反应是放热的氧化还原反应.
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2C0(g)+02 (g)═2C02 (g )反应放热,且为氧化还原反应,故可以设计成原电池,故C正确;
D.2H2(g)+O2(g)=2H2O(1)△H<0,该反应为氧化还原反应,且为放热反应,能设计为原电池,故D正确;
故答案为:CD;
(3)若为一氧化碳燃料电池,在熔融的K2CO3与CO2为反应的环境中,传到离子为碳酸根离子,负极是一氧化碳失电子生成二氧化碳,电极反应为:CO-2e-+CO32-=2CO2 ;若为氢氧燃料电池,则负极上放电的为氢气,电极反应为:H2-2e-=2H+,故答案为:CO-2e-+CO32-=2CO2或H2-2e-=2H+.
点评 本题考查原电池的设计和燃料电池的电极反应书写,题目难度中等,明确原电池与氧化还原反应的关系及负极发生氧化反应是解答本题的关键,试题培养了学生的灵活应用能力.

| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
| A. | H2O2的相对分子质量为34g | |
| B. | CH4的摩尔质量为16 g | |
| C. | 1 mol SO42--的质量为96g | |
| D. | 标准状况下1 mol H2O 的体积是22.4 L |
| A. | 1.2mol | B. | 1.6mol | C. | 0.4mol | D. | 0.2mol |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |

下列关于橙花醇的叙述,正确的是( )
| A. | 橙花醇的分子式为C15H24O | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 在一定条件下能发生取代、催化氧化、酯化、加聚反应 | |
| D. | 0.1mo1橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗0.3mo1Br2 |