题目内容
6.要使在密闭容器中进行的可逆反应2A(g)+B(s)?2C(g)的正反应速率加快,可采取的措施是( )| A. | 恒压下充N2 | B. | 加B | C. | 恒容下充N2 | D. | 加A |
分析 对于反应2A(g)+B(s)?2C(g)来说,增大浓度、温度、压强或加入催化剂都可增大反应速率,注意B为固体的特点,以此解答.
解答 解:A.恒压下充N2,体积增大,参加反应的气体的浓度减小,反应速率减小,故A错误;
B.B为固体,加入B,反应速率不变,故B错误;
C.恒容下充N2,虽然压强增大,但参加反应的气体的浓度不变,反应速率不变,故C错误;
D.加入A,则气体浓度增大,反应速率增大,故D正确.
故选D.
点评 本题考查化学反应速率的影响,侧重于学生的分析能力的考查,为高考常见题型,把握B为固体的特点,为解答该题的关键,难度不大,答题时注意审题,把握题给信息.

练习册系列答案
相关题目
16.下列实验能达到目的是( )
| A. | 用萃取分液的方法除去酒精中的水 | |
| B. | 将NH4Cl溶液蒸干制备NH4Cl固体 | |
| C. | 用可见光束照射以区别溶液和胶体 | |
| D. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
17.在一定温度下的恒容密闭容器中,当下列哪些量不再发生变化时,表明下述反应:A(s)+2B(g)=C(g)+D(g)已达到平衡状态:
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C的百分含量 ⑦各气体的物质的量 ⑧当有1molB气体分子断键,同时有1/2molC气体分子断键( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥物质C的百分含量 ⑦各气体的物质的量 ⑧当有1molB气体分子断键,同时有1/2molC气体分子断键( )
| A. | ②③⑤⑥⑦⑧ | B. | ①②③⑥⑦⑧ | C. | ②③④⑤⑥⑧ | D. | ①③④⑤⑦ |
14.已知常温下NaHSO3 溶液的pH小于7,下列关于0.10mol•L-1 的NaHSO3 溶液的说法正确的是( )
| A. | c(Na+ )=c(HSO3-) | B. | c(H2SO3)>c(SO32-) | ||
| C. | c(Na+ )=c(SO32-)+c(HSO3-) | D. | c(Na+ )+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-) |
4.加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下性质稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.工业生产碘酸钾的流程如下:
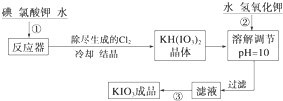
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3.
参照碘酸钾的溶解度:
操作③的方法是蒸发结晶.
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有液体分层,下层液体呈现紫红色.
学生乙对纯净的NaCl进行了如下实验:取1g纯净的NaCl,加3mL水配成溶液,然后滴入5滴淀粉溶液和1mL 0.1mol•L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1mol•L-1的H2SO4,振荡,一段时间后溶液变浅蓝色.请推测实验中产生蓝色现象的可能原因,用离子方程式表示4I-+4H++O2═2I2+2H2O.
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇.丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:Ca2++2IO${\;}_{3}^{-}$+6H2O═Ca(IO3)2•6H2O;检验沉淀已经洗涤干净的方法是在最后一次洗涤液中加入硝酸银溶液,若无白色沉淀说明已经洗涤干净.

(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3.
参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有液体分层,下层液体呈现紫红色.
学生乙对纯净的NaCl进行了如下实验:取1g纯净的NaCl,加3mL水配成溶液,然后滴入5滴淀粉溶液和1mL 0.1mol•L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1mol•L-1的H2SO4,振荡,一段时间后溶液变浅蓝色.请推测实验中产生蓝色现象的可能原因,用离子方程式表示4I-+4H++O2═2I2+2H2O.
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇.丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:Ca2++2IO${\;}_{3}^{-}$+6H2O═Ca(IO3)2•6H2O;检验沉淀已经洗涤干净的方法是在最后一次洗涤液中加入硝酸银溶液,若无白色沉淀说明已经洗涤干净.
11.研究和深度开发CO、CO2的应用对构建生态文明社会有重要的意义.
(1)已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol.
(2)CO2和H2充入一定体积的密闭容器中,
在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
测得CH3OH的物质的量随时间的变化见图1.
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ> KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<n(c)≤1mol.
(3)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为II>III>I(填序号).
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.

(1)已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol.
(2)CO2和H2充入一定体积的密闭容器中,
在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
测得CH3OH的物质的量随时间的变化见图1.
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ> KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
(3)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为II>III>I(填序号).
(4)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.

8.下列性质的递变中,正确的是( )
| A. | N、P、Mg的原子半径依次减小 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | HF、H2O、SiH4的稳定性依次减弱 | D. | HCl、HBr、HI的酸性依次减弱 |
9.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 25℃时,l L pH=13的 Ba(OH)2溶液中含有的OH-数为0.2 NA | |
| B. | 18g D2O中含有的质子数为9NA | |
| C. | Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5 NA |