题目内容
11.某研究性学习小组将甲、乙、丙装置连接如图,除G、H外所有电极均为惰性电极.电解一段时间后,D电极质量增加.试回答下列问题:
(1)电源A极是正极(填“正”或“负”);乙装置F电极附近的现象是溶液变红.
(2)欲用丙装置给铜镀银.G应该是Ag(填“Ag”或“Cu”).
(3)如用甲醇燃料电池(如图丁)充当电源,写出负极的电极反应方程式:CH3OH-6e-+8OH-=CO32-+6H2O;若用戊装置(如图)代替乙装置,写出丁装置中反应的总化学方程式是NaCl+H2O$\frac{\underline{\;放电\;}}{\;}$NaClO+H2↑.
分析 (1)D电极质量增加,说明D是阴极,铜离子放电生成单质铜,从而确定A是电源的正极、B极是电源的负极,F是电解池的阴极,电极反应式为:氢离子放电生成氢气,F极呈碱性,酚酞呈红色;
(2)欲用丙装置给铜镀银,G是阳极,应该是镀层金属银;
(3)负极是燃料发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;若用戊装置(如图)代替乙装置,E是氯离子放电,F是氢离子放电,所以丁装置中反应的总化学方程式是NaCl+H2O=NaClO+H2↑.
解答 解:(1)D电极质量增加,说明D是阴极,铜离子放电生成单质铜,从而确定A是电源的正极、B极是电源的负极,F是电解池的阴极,电极反应式为:氢离子放电生成氢气,F极呈碱性,酚酞呈红色,故答案为:正;溶液变红;
(2)欲用丙装置给铜镀银,G是阳极,应该是镀层金属银,故答案为:Ag;
(3)负极是燃料发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;若用戊装置(如图)代替乙装置,E是氯离子放电,F是氢离子放电,所以丁装置中反应的总化学方程式是NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;NaCl+H2O$\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑.
点评 本题以电解池原理为载体考查了正负极的判断、电极反应式的书写等知识点,难度中等,明确溶液中离子的放电顺序是解本题的关键.

练习册系列答案
相关题目
1.X、Y、Z是原子序数依次增大且属于不同周期的三种常见短周期元素,三种元素相互之间可以形成1:1型的化合物M、N、R,常温下M、N为固体,R为液体.M、N遇到水都能产生气体,而且产生的气体相互可以化合,下列说法正确的是( )
| A. | 三种元素都是非金属元素 | B. | M、N投入水中所得溶液中溶质相同 | ||
| C. | 三种化合物都是共价化合物 | D. | Z是地壳中含量最多的元素 |
2.下列芳香烃的一氯取代物的同分异构体数目最多的是( )
| A. | 连二苯 | B. | 菲 | C. | 蒽 | D. | 连三苯 |
6.下列因果关系叙述错误的是( )
| A. | 乙炔中碳原子形成的是sp杂化轨道,因此易于发生加成反应和氧化反应 | |
| B. | 金属锂的摩尔质量小,因此锂电池具有比能量大的优点 | |
| C. | 苯环中含有大π键,因此易于发生加成反应,难于发生取代反应 | |
| D. | 相同温度、相同浓度的CH3COOH与NH3•H2O的电离能力相同,因此CH3COONH4溶液呈中性 |
3.以下说法不正确的是( )
| A. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| B. | 麦芽糖及其水解产物均能发生银镜反应 | |
| C. | 用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 | |
| D. | 将甘氨酸和丙氨酸混合后缩合最多可形成4种二肽 |
20.邻甲基苯甲酸( )有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )
)有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )
 )有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )
)有多种同分异构体,其中属于酯类,且分子结构中含有甲基和苯环的异构体有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
1.关于下列各实验的叙述中,不正确的是( )
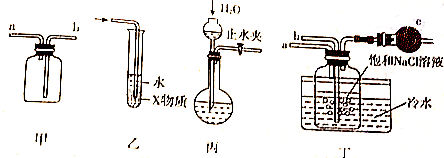

| A. | 装置甲可用于收集H2、NH3、CO2、Cl2等气体 | |
| B. | 装置乙中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| C. | 装置丙可以用于检验装置气密性 | |
| D. | 装置丁中b通入CO2,然后a通入NH3,用于实验室模拟制备NaHCO3 |
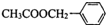 )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如下:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如下: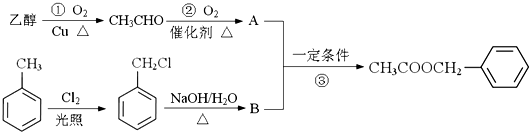
 制备
制备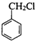 C.2CH3CHO+O2$\underset{\stackrel{催化剂}{→}}{△}$2A
C.2CH3CHO+O2$\underset{\stackrel{催化剂}{→}}{△}$2A