题目内容
 实验室中某些气体的制取、收集及尾气处理装置如图所示.仅用此装置和表中提供的物质完成相关实验,最合理的是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示.仅用此装置和表中提供的物质完成相关实验,最合理的是( )| 选项 | a中物质 | b中物质 | c中收集的气体 | d中物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 饱和食盐水 | 电石 | CH≡CH | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A、A | B、B | C、C | D、D |
分析:A、氨气密度小于空气的密度,收集方法应该为向下排空气法;
B、浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫密度大于空气,氢氧化钠溶液能够与二氧化硫反应,应该使用放倒吸装置;
C、乙炔密度小于空气、乙炔不与水反应,不能用水吸收多余的气体;
D、浓盐酸溶液挥发,制取的氯气中混有氯化氢,导致制取的气体不纯.
B、浓硫酸与亚硫酸钠反应生成二氧化硫,二氧化硫密度大于空气,氢氧化钠溶液能够与二氧化硫反应,应该使用放倒吸装置;
C、乙炔密度小于空气、乙炔不与水反应,不能用水吸收多余的气体;
D、浓盐酸溶液挥发,制取的氯气中混有氯化氢,导致制取的气体不纯.
解答:解:A、氨气的密度比水小,装置c中应该改为短进长出,故A错误;
B、浓硫酸可以与亚硫酸反应,生成二氧化硫,SO2气体的密度比空气大,能使用向上排空气法,SO2气体能与氢氧化钠迅速反应,所以吸收时要防倒吸,故B正确;
C、乙炔的密度小于空气,且不溶于水,不能用水吸收多余的乙炔,故C错误;
D、由于盐酸易挥发,所以c中收集的气体不纯净,应该在bc之间设计除去挥发出来的氯化氢,故D错误;
故选B.
B、浓硫酸可以与亚硫酸反应,生成二氧化硫,SO2气体的密度比空气大,能使用向上排空气法,SO2气体能与氢氧化钠迅速反应,所以吸收时要防倒吸,故B正确;
C、乙炔的密度小于空气,且不溶于水,不能用水吸收多余的乙炔,故C错误;
D、由于盐酸易挥发,所以c中收集的气体不纯净,应该在bc之间设计除去挥发出来的氯化氢,故D错误;
故选B.
点评:本题考查化学实验基本原理(气体的制备)、实验装置、仪器的使用,题目难度中等,该考点是高考的热点,本题对相关的知识考查的要求较高,本题有利于培养学生对实验的分析能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
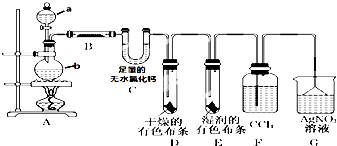 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)①分别写出a、b的实验仪器名称


