题目内容
2.饱和氯水中存在如下平衡:①Cl2+H2O?H++Cl-+HClO;②HClO?H++ClO-,将饱和氯水倒入试管中分别进行下列实验,相应分析结论错误的是( )| A. | 通入过量Cl2,①、②均向右移动,溶液pH减小 | |
| B. | 加入CaCO3悬浊液,CaCO3的溶解平衡向右移动 | |
| C. | 加入澄清石灰水,c(H+)一定减小 | |
| D. | 加入一定量NaOH溶液后,溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
分析 饱和氯水中存在平衡:①C12+H2O?H++Cl-+HClO,②HClO?H++ClO-,其中盐酸酸性比碳酸强,次氯酸酸性比碳酸弱,结合浓度对平衡移动的影响解答该题.
解答 解:A.因为是饱和氯水,再通入氯气不溶解,平衡不移动,溶液的pH不变,故A错误;
B.加入CaCO3悬浊液,存在CaCO3(s)?Ca2+(aq)+CO32-(aq),氯水中的氢离子与碳酸根离子反应,碳酸根离子浓度减小,溶解平衡向右移动,故B正确;
C.加入澄清石灰水,与氢离子反应,导致c(H+)减小,故C正确;
D.加入一定量NaOH溶液后,如果溶液呈中性,结合电荷守恒,则有c(Cl-)+c(ClO-)=c(Na+),故D正确.
故选A.
点评 本题考查氯气的性质以及弱电解质在水中的电离和电离平衡的移动,侧重于学生的分析能力的考查,学注意掌握平衡移动的原理,难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
6.将10mL NO和NO2的混合气体通入装满水的倒立在水槽中的量筒里,充分反应后,最后剩余6mL气体,则原混合气体中NO的体积为( )
| A. | 1mL | B. | 4mL | C. | 5mL | D. | 7mL |
7.活泼金属的碳化物都是易水解的物质,例如:
Al4C3+12H2O→4Al(OH)3+3CH4↑
Mg2C3+4H2O→2Mg(OH)2+C3H4↑
完成下列计算:
(1)如果需要制取10.08L的乙炔(标准状况下),至少需要30g CaC2含量为96%的电石.
(2)金属碳化物Al4C3与Mg2C3组成的混合物与一定量的水反应,实验数据如下:
计算:
①混合物中Al4C3与Mg2C3的物质的量之比=1:2;
②a=22.5g;
(3)甲烷通过激光分解可制得乙炔.
主反应:2CH4→C2H2+3H2;副反应:CH4→C(s)+2H2.
在一烧瓶中加入Al4C3与CaC2组成的混合物,再向烧杯中加入足量的水,充分反应后,烧瓶质量减轻了7.4g,同时收集到气体8.96L(折算为标况).通过激光分解后,得到的气体的平均相对分子质量为11,同时有0.03g碳生成,计算甲烷的分解率.
Al4C3+12H2O→4Al(OH)3+3CH4↑
Mg2C3+4H2O→2Mg(OH)2+C3H4↑
完成下列计算:
(1)如果需要制取10.08L的乙炔(标准状况下),至少需要30g CaC2含量为96%的电石.
(2)金属碳化物Al4C3与Mg2C3组成的混合物与一定量的水反应,实验数据如下:
| 实验组号 | ① | ② | ③ | ④ |
| 碳化物(g) | 7.8 | 15.6 | 23.4 | 31.2 |
| 水(mL) | 18 | 18 | a | a |
| 气体(L/标况) | 2.8 | 5.6 | 7 | 7 |
①混合物中Al4C3与Mg2C3的物质的量之比=1:2;
②a=22.5g;
(3)甲烷通过激光分解可制得乙炔.
主反应:2CH4→C2H2+3H2;副反应:CH4→C(s)+2H2.
在一烧瓶中加入Al4C3与CaC2组成的混合物,再向烧杯中加入足量的水,充分反应后,烧瓶质量减轻了7.4g,同时收集到气体8.96L(折算为标况).通过激光分解后,得到的气体的平均相对分子质量为11,同时有0.03g碳生成,计算甲烷的分解率.
10.下列说法错误的是( )
| A. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| B. | 醋酸和硬脂酸互为同系物,C2H4和C18H38也互为同系物 | |
| C. | 有机物W(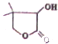 )和其水解产物都可以发生消去反应 )和其水解产物都可以发生消去反应 | |
| D. | 乙烯的加成反应及与酸性KMnO4溶液作用,都与其分子内碳碳双健有关 |
14.下列反应的离子方程式书写正确的是( )
| A. | 二氧化硫通入溴水使其褪色 SO2+Br2+2H2O═4H++2Br-+SO32- | |
| B. | 石灰石与稀盐酸 CO32-+2H+═H2O+CO2↑ | |
| C. | 小苏打溶液中滴加醋酸溶液 HCO3-+CH3COOH=CH3COO-+H2O+CO2↑ | |
| D. | 氯化铝溶液中加入过量的氨水 Al3++4 NH3•H2O=4NH4++AlO2-+2H2O |
11.科学家观测到固体催化剂表面“抓取”一氧化碳分子和氧原子配对生成二氧化碳分子的过程.下列关于碳的氧化物的说法正确的是( )
| A. | CO与CO2均为酸性氧化物 | B. | CO是煤气的主要成分之一 | ||
| C. | CO2是弱电解质 | D. | 大量CO2的排放可导致酸雨的形成 |
12.放射性同位素钬${\;}_{67}^{166}$Ho的原子核内的中子数与质子数之差是( )
| A. | 166 | B. | 99 | C. | 67 | D. | 32 |