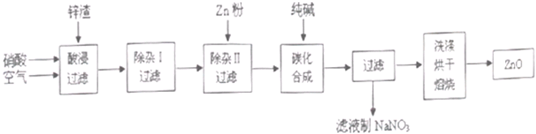
题目内容
将![]() +Zn+OH-+H2O→NH3+
+Zn+OH-+H2O→NH3+![]() 配平后,离子方程式中H2O的系数是
配平后,离子方程式中H2O的系数是
[ ]
A.2 B.4 C.6 D.8
答案:C

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4?H2O的流程如下:
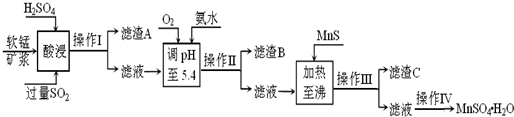
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、Al、Zn、Cu等.25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 .酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 .

(2)滤渣B的主要成分是 .
(3)加入MnS的目的是 .
(4)操作IV的步骤为 、 、过滤、洗涤、干燥.
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: .
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程).

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、Al、Zn、Cu等.25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为

(2)滤渣B的主要成分是
(3)加入MnS的目的是
(4)操作IV的步骤为
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为:
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为