题目内容
X、Y、Z、D、E、G六种短周期元素的原子序数依次递增.X、Y、D元素的基态原子中电子层数与未成对电子数均相等;D、E属于同族元素,G单质的水溶液和ED2化合物均具有漂白性;R元素的M层全满,N层只有1个电子.
请回答下列问题:(用对应的元素符号表示)
(1)R元素在元素周期表分区中属于 区元素,Y、Z、D三种元素中电负性由小到大的顺序是 .
(2)X3D+的中心原子杂化轨道类型是 ,该离子的立体构型是 .
(3)向RED4的水溶液中加入ZX3的水溶液至过量,有关反应的离子方程式是 .
(4)用惰性电极电解RED4溶液一段时间后,加入0.1molR(DX)2恢复到原来的状态,电解过程中转移电子的物质的量为 .
(5)向RG2的水溶液通入ED2,产生白色沉淀RG,该反应的离子方程式是 .
请回答下列问题:(用对应的元素符号表示)
(1)R元素在元素周期表分区中属于
(2)X3D+的中心原子杂化轨道类型是
(3)向RED4的水溶液中加入ZX3的水溶液至过量,有关反应的离子方程式是
(4)用惰性电极电解RED4溶液一段时间后,加入0.1molR(DX)2恢复到原来的状态,电解过程中转移电子的物质的量为
(5)向RG2的水溶液通入ED2,产生白色沉淀RG,该反应的离子方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由题意知,D、E属于同族元素,G的单质的水溶液和ED2均有漂白性,故G为Cl元素,ED2为SO2,即E为S,D为O,又X、Y、D元素元素原子中电子层数与未成对电子数均相等,X、Y、D原子序数依次递增,故X为H,Y为C,Z为N元素;R元素的M层全满,N层只有1个电子,则为Cu元素,以此解题.
解答:
解:由题意知,D、E属于同族元素,G的单质的水溶液和ED2均有漂白性,故G为Cl元素,ED2为SO2,即E为S,D为O,又X、Y、D元素元素原子中电子层数与未成对电子数均相等,X、Y、D原子序数依次递增,故X为H,Y为C,Z为N元素;R元素的M层全满,N层只有1个电子,则R为Cu元素.
(1)Cu位于周期表第4周期ⅠB族,外围电子构型为:3d104s1,属于ds区元素;同周期从左到右电负性依次增大,故电负性由小到大顺序为:C<N<O;故答案为:ds;C<N<O;
钠离子周围有6个氯离子,其配位数为6;与钠离子距离最近且相等的钠离子个数为12个,故答案为:6;12;
(2)水合氢离子中价层电子对个数=3+
(6-1-3×1)=4,且该微粒中含有一个孤电子对,所以水合氢离子为三角锥形,氧原子杂化方式为sp3;
故答案为:sp3;三角锥形;
(3)硫酸铜和过量氨水反应先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液,发生Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,故答案为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度,Cu(OH)2从组成上可看成CuO?H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成0.1mol铜转移电子=0.1mol×2mol=0.2mol,根据原子守恒知,生成0.1mol水需要0.1mol氢气,生成0.1mol氢气转移电子=0.1mol×2mol=0.2mol,所以电解过程中共转移电子数为0.4mol,故答案为:0.4mol;
(5)二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和氯化铜发生氧化还原反应生成氯化亚铜和硫酸,离子反应方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+,故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
(1)Cu位于周期表第4周期ⅠB族,外围电子构型为:3d104s1,属于ds区元素;同周期从左到右电负性依次增大,故电负性由小到大顺序为:C<N<O;故答案为:ds;C<N<O;
钠离子周围有6个氯离子,其配位数为6;与钠离子距离最近且相等的钠离子个数为12个,故答案为:6;12;
(2)水合氢离子中价层电子对个数=3+
| 1 |
| 2 |
故答案为:sp3;三角锥形;
(3)硫酸铜和过量氨水反应先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液,发生Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,故答案为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度,Cu(OH)2从组成上可看成CuO?H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,生成0.1mol铜转移电子=0.1mol×2mol=0.2mol,根据原子守恒知,生成0.1mol水需要0.1mol氢气,生成0.1mol氢气转移电子=0.1mol×2mol=0.2mol,所以电解过程中共转移电子数为0.4mol,故答案为:0.4mol;
(5)二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和氯化铜发生氧化还原反应生成氯化亚铜和硫酸,离子反应方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+,故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
点评:本题综合考查原子核外电子排布、原子结构及分子的立体结构、物质成键情况,综合性较强,具有一定的难度.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
要测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数可采取不同的方法,取a克样品与一定量稀盐酸(过量)充分反应后,下列说法正确的是( )
| A、逸出气体若用碱石灰吸收,增重b克.则测定混合物中Na2CO3的质量分数偏小 |
| B、把所得溶液加热蒸干,并灼烧至恒重,得b克固体.蒸干过程中若未搅拌,则所测Na2CO3的质量分数可能偏大 |
| C、某NaOH标准溶液露置于空气中一段时间后,以甲基橙为指示剂,仍用此碱液滴定上述反应后的溶液,则所测Na2CO3的质量分数偏大 |
| D、产生的气体冷却至室温后,若测定其体积时忘记调平量气管和水准管内液面,则导致Na2CO3的质量分数偏小 |
下列对有机物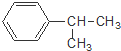 的叙述中,不正确的是( )
的叙述中,不正确的是( )
 的叙述中,不正确的是( )
的叙述中,不正确的是( )| A、它难溶于水,但易溶于苯. |
| B、它会使酸性高锰酸钾溶液褪色 |
| C、与Br2发生取代反应可生成三种一溴代物 |
| D、一定温度下可以和浓硝酸、浓硫酸的混合物发生硝化反应 |
下列溶液中,Cl-的物质的量浓度与50mL 1mol/L AlCl3溶液中Cl-物质的量浓度相等是( )
| A、100mL 1mol/LNaCl溶液 |
| B、150mL 3mol/LKCl溶液 |
| C、75mL 1mol/LMgCl2溶液 |
| D、25mL 2mol/LAlCl3溶液 |