题目内容
根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A、铍原子失电子能力比镁弱 |
| B、氢氧化钾碱性比氢氧化镁强 |
| C、硒化氢比硫化氢稳定 |
| D、碳酸比硅酸酸性强 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A.同一主族元素,元素的金属性随着原子序数的增大而增强,元素的金属性越强,其失电子的能力越强;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.元素的非金属性越强,其气态氢化物越稳定;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.元素的非金属性越强,其气态氢化物越稳定;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答:
解:A.同一主族元素,元素的金属性随着原子序数的增大而增强,元素的金属性越强,其失电子的能力越强,镁的金属性大于Be,所以Mg失电子能力大于Be,故A正确;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,K的金属性大于Mg,所以KOH的碱性大于Mg(OH)2,故B正确;
C.元素的非金属性越强,其气态氢化物越稳定,S的非金属性大于Se,所以硫化氢的稳定性大于硒化氢,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,碳的非金属性大于Si,所以碳酸的酸性大于硅酸,故D正确;
故选C.
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,K的金属性大于Mg,所以KOH的碱性大于Mg(OH)2,故B正确;
C.元素的非金属性越强,其气态氢化物越稳定,S的非金属性大于Se,所以硫化氢的稳定性大于硒化氢,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,碳的非金属性大于Si,所以碳酸的酸性大于硅酸,故D正确;
故选C.
点评:本题考查了元素周期表和元素周期律的应用,根据元素金属性强弱与其最高价氧化物的水化物碱性强弱、元素非金属性强弱与其最高价氧化物的水化物酸性强弱及其氢化物的稳定性之间的关系分析解答,题目难度不大,为考试热点.

练习册系列答案
相关题目
下列说法正确的是( )
| A、标准状况下,11.2LHCl中含 6.02×1023个离子 |
| B、△H<0,△S>0的化学反应一定能自发进行 |
| C、pH=5的盐酸,稀释1000倍后,溶液pH约为8 |
| D、NaHA溶液PH>7,则c(Na+)=c(HA-)+c(H2A)+2c(A2-) |
下列反应的离子方程式正确的是( )
| A、向澄清石灰水中滴加盐酸:Ca(OH)2+2H+=Ca2++2H2O |
| B、向铜粉中加入稀H2SO4:Cu+2H+=Cu2++H2↑ |
| C、向CuSO4溶液中加入Fe粉:Fe+Cu2+=Fe2++Cu |
| D、向AgNO3溶液中加入Cu粉:Ag++Cu=Cu2++Ag |
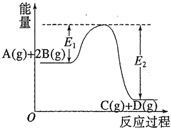 反应A(g)+2B(g)?C(g)+D(g)过程中的能量变化如图所示,有关叙述正确的是( )
反应A(g)+2B(g)?C(g)+D(g)过程中的能量变化如图所示,有关叙述正确的是( )| A、该反应是吸热反应 |
| B、当反应达到平衡时,升高温度,A的转化率增大 |
| C、反应体系中加入催化剂对反应热无影响 |
| D、在反应体系中加入催化剂,反应速率增大,E1减小,E2不变 |
决定化学反应的主要因素是( )
| A、温度 | B、压强 |
| C、浓度 | D、反应物本身的性质 |
能用H++OH-=H2O来表示的化学反应是( )
| A、氢氧化铜和稀盐酸反应 |
| B、Ba(OH)2溶液中滴入稀硫酸 |
| C、KOH溶液和稀硝酸反应 |
| D、CH3COOH与NaOH溶液反应 |
含氢氧化钠0.25mol的稀溶液与足量的稀盐酸反应,放出14.35kJ的热量,表示该反应的热化学方程式是( )
| A、NaOH (aq)+HCl (aq)═NaCl (aq)+H2O (l)△H=-14.35 kJ?mol-1 |
| B、NaOH (aq)+HCl (aq)═NaCl (aq)+H2O (l)△H=-28.70 kJ?mol-1 |
| C、NaOH+HCl═NaCl+H2O△H=-57.40 kJ?mol-1 |
| D、NaOH (aq)+HCl (aq)═NaCl (aq)+H2O (l)△H=-57.40 kJ?mol-1 |