题目内容
A、B、C三种元素的原子具有相同的电子层数,B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4,1molA的单质跟盐酸反应可置换出11.2L(标准状况)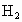 ,这时A的离子与氖原子的电子层结构相同.试回答:
,这时A的离子与氖原子的电子层结构相同.试回答:
(1)A是________元素,B是________元素,C是________元素.
(2)分别写出A、B、C最高价氧化物对应水化物之间反应的离子方程式________.
(3)A离子的氧化性比B离子的氧化性________,这是由于________.
答案:略
解析:
提示:
解析:
|
(1)Na ,Al,Cl(2) 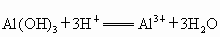 ; ;
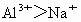 |
提示:
|
(1)1molA 的单质与盐酸反应时可产生 ,说明A在反应中显+1价,形成的离子同Ne原子具有相同的电子层结构,A应为Na,由已知A、B、C具有相同的电子层数B的核电荷数比A大2,则B为Al元素,C原子的电子总数比B原子多4,则C为Cl元素. ,说明A在反应中显+1价,形成的离子同Ne原子具有相同的电子层结构,A应为Na,由已知A、B、C具有相同的电子层数B的核电荷数比A大2,则B为Al元素,C原子的电子总数比B原子多4,则C为Cl元素.
(2) 最高价氧化物的水化物:A是NaOH,B是 ,C是 ,C是 ;有关的反应离子方程式: ;有关的反应离子方程式: , , , ,
(3)  弱,是由于 弱,是由于 半径比 半径比 的小,获得的电子能力 的小,获得的电子能力 |

练习册系列答案
相关题目
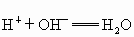
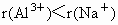


 如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)
如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)