题目内容
13.用足量的一氧化碳还原14.5g铁的氧化物的混合物.将生成的气体通入足量的澄清石灰水中,生成沉淀25g,则该混合物的组合不可能是( )| A. | Fe2O3、Fe3O4、FeO | B. | FeO、Fe3O4 | C. | Fe3O4、Fe2O3 | D. | FeO、Fe2O3 |
分析 假设铁的氧化物的化学式为FexOy,则它与一氧化碳反应的方程式为:FexOy+yCO$\frac{\underline{\;高温\;}}{\;}$xFe+yCO2,Ca(OH)2+CO2═CaCO3↓+H2O,依据铁的氧化物与一氧化碳以及二氧化碳和氢氧化钙反应的方程式推算铁的氧化物的化学式进而对相关选项作出判断.
解答 解:假设铁的氧化物的化学式为FexOy,则它与一氧化碳反应的方程式为:FexOy+yCO$\frac{\underline{\;高温\;}}{\;}$xFe+yCO2,Ca(OH)2+CO2═CaCO3↓+H2O,
所以可建立FexOy~yCO2~yCaCO3的关系式;
则有FexOy~yCO2~yCaCO3
56x+16y 100y
14.5g 25g
$\frac{56x+16y}{100y}$=$\frac{14.5g}{25g}$
解得$\frac{x}{y}$=$\frac{3}{4}$
则该物质为Fe3O4或FeO、Fe2O3或Fe2O3、Fe3O4、FeO.
故选BC.
点评 本题考查混合物的质量计算,题目难度中等,根据反应方程式中各物质之间的关系计算,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
1.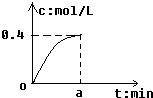 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
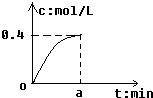 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 0.1 | B. | 2.5 | C. | 5 | D. | 10 |
8.加入适量的H2SO4溶液,可使溶液中下列离子的数目显著减少的是( )
| A. | Cl- | B. | Na+ | C. | CO32- | D. | SO42- |
18.向100mL0.1mol/L的硫酸铝溶液中滴加0.5mol/L的氢氧化钠溶液,如果得到1.17g沉淀,则消耗的氢氧化钠溶液的体积为( )
| A. | 130ml | B. | 100ml | C. | 90ml | D. | 50ml |
5.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的3倍.下列有关叙述正确的是( )
| A. | Y的价层电子排布式为3s23p5 | |
| B. | 稳定性:Y的氢化物>Z的氢化物 | |
| C. | 第一电离能:Y<Z | |
| D. | X、Y两元素形成的化合物为离子化合物 |
3.将19gKOH和KHCO3的混合物,在260℃时煅烧充分反应,冷却后称量,固体质量减少0.98g,则混合物中KOH和KHCO3的物质的量关系正确的是( )
| A. | n(KOH)=n(KHCO3) | B. | n(KOH)<n(KHCO3) | C. | n(KOH)>n(KHCO3) | D. | KOH、KHCO3任意比 |