题目内容
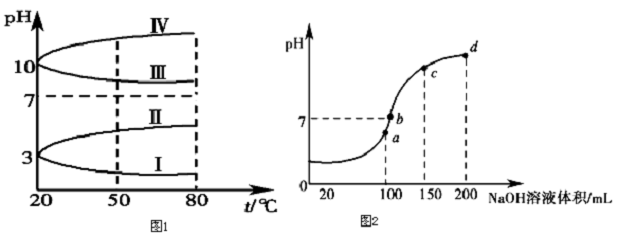
硫酸钠又名无水芒硝,白色、无臭、有苦味的结晶或粉末,有吸湿性.主要用于制水玻璃、玻璃、瓷釉、纸浆、致冷混合剂、洗涤剂、干燥剂、染料稀释剂、分析化学试剂、医药品等.工业上硫酸钠是以氯化钠和硫酸铵为原料制备的,工艺流程如图1所示;硫酸钠的溶解度氯化铵的溶解度随温度变化如图2所示:

请回答下列问题:
(1)欲制备21.4g NH4Cl,理论上需NaCl g.
(2)实验室进行蒸发浓缩用到的主要仪器有 .
(3)“冷却结晶”过程中,析出NH4Cl晶体的最合适温度为 .
(4)如果不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是 .
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 .

请回答下列问题:
(1)欲制备21.4g NH4Cl,理论上需NaCl
(2)实验室进行蒸发浓缩用到的主要仪器有
(3)“冷却结晶”过程中,析出NH4Cl晶体的最合适温度为
(4)如果不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)根据Cl元素守恒计算NaCl的质量;
(2)蒸发液体用蒸发皿;
(3)从溶解度曲线判断硫酸钠和氯化铵的溶解度变化特点分析,在35-45℃时,氯化铵的溶解度小于硫酸钠的溶解度;
(4)根据氯化铵受热时分解生成了氨气和氯化氢气体,可用加热法检查NH4Cl产品是否纯净;
(5)根据氯化铵加热易分解,硫酸钠加热难以分解分析.
(2)蒸发液体用蒸发皿;
(3)从溶解度曲线判断硫酸钠和氯化铵的溶解度变化特点分析,在35-45℃时,氯化铵的溶解度小于硫酸钠的溶解度;
(4)根据氯化铵受热时分解生成了氨气和氯化氢气体,可用加热法检查NH4Cl产品是否纯净;
(5)根据氯化铵加热易分解,硫酸钠加热难以分解分析.
解答:
解:(1)21.4g NH4Cl的物质的量为
=0.4mol,根据Cl元素守恒,需要NaCl的物质的量也为0.4mol,质量为0.4mol×58.5g/mol=23.4g,故答案为:23.4;
(2)实验室进行蒸发浓缩用到的主要仪器有 蒸发皿、烧杯、玻璃棒、酒精灯等,故答案为:蒸发皿;
(3)根据硫酸钠的溶解度曲线不难看出,在低于40℃时,硫酸钠的溶解度随温度的升高而增大,高于40℃时硫酸钠的溶解度随温度的升高而减小;由两物质的溶解度曲线不难看出,只有在35~45℃时,氯化铵的溶解度小于硫酸钠的溶解度,故答案为:35℃(33℃~40℃均可);
(4)根据氯化铵受热时分解生成了氨气和氯化氢气体,可用加热法检查NH4Cl产品是否纯净,操作是:取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净,故答案为:加热法;
(5)氯化铵加热易分解,硫酸钠加热难以分解,将样品加热,收集试管口物质,可将二者分离,故答案为:加热样品,并收集试管口产物.
| 21.4g |
| 53.5g/mol |
(2)实验室进行蒸发浓缩用到的主要仪器有 蒸发皿、烧杯、玻璃棒、酒精灯等,故答案为:蒸发皿;
(3)根据硫酸钠的溶解度曲线不难看出,在低于40℃时,硫酸钠的溶解度随温度的升高而增大,高于40℃时硫酸钠的溶解度随温度的升高而减小;由两物质的溶解度曲线不难看出,只有在35~45℃时,氯化铵的溶解度小于硫酸钠的溶解度,故答案为:35℃(33℃~40℃均可);
(4)根据氯化铵受热时分解生成了氨气和氯化氢气体,可用加热法检查NH4Cl产品是否纯净,操作是:取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净,故答案为:加热法;
(5)氯化铵加热易分解,硫酸钠加热难以分解,将样品加热,收集试管口物质,可将二者分离,故答案为:加热样品,并收集试管口产物.
点评:本题难度不是很大,主要考查了根据固体物质的溶解度曲线解决相关的问题,培养学生分析问题、解决问题的能力.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
下列说法中不正确的是( )
| A、溶解度:Na2CO3大于NaHCO3 |
| B、稳定性:Na2CO3大于NaHCO3 |
| C、与酸反应剧烈程度:NaHCO3大于Na2CO3 |
| D、石灰水可与Na2CO3反应而不与NaHCO3反应 |
由Fe O、Fe2O3、Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21:8,则这种混合物中FeO、F203、Fe304的物质的量之比可能是( )
①1:2:1 ②2:1:1 ③1:1:1 ④1:1:3 ⑤2:2:3.
①1:2:1 ②2:1:1 ③1:1:1 ④1:1:3 ⑤2:2:3.
| A、①③ | B、③④⑤ | C、②③ | D、全部 |
下列实验操作或装置正确的是( )
A、 制取氧气时选用装置 |
B、 量筒的度数 |
C、 高锰酸钾制取氧气 |
D、 过滤 |
常温下,将Na2CO3和NaHCO3混合物〔
=a a≤3〕溶于水制得稀溶液,下列有关该溶液中微粒的物质的量浓度关系正确的是( )
| n(Na2CO3) |
| n(NaHCO3) |
| A、a=1则c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B、a=2则c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、a为任意值时,则c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、a=0则c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |