题目内容
某课外活动小组同学用如图装置进行实验,试回答下列问题。 
(1)若开始时开关K与b连接,则B极的电极反应式为 ,总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(2)上述实验反应一小段时间后,再把开关K与a连接,则B极的电极反应式为 。
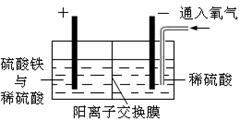
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,则可以设想用如下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填”大于”或”小于”或”等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口 (填写“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
⑤燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。液态肼(分子式N2H4)可以在氟气中燃烧生成氮气和氟化氢。利用肼、氟气与KOH溶液组成碱性燃料电池,请写出该电池负极的电极反应式:? ? .
(1)2H++2e-=H2↑ 2Cl-+ 2H2O 2OH-+H2↑+Cl2↑;②
2OH-+H2↑+Cl2↑;②
(2)Fe-3e-+3OH-=Fe(OH)3
(3)①4OH--4e-= 2H2O+O2↑;小于
②D
③氢离子放电,促进水的电离,氢氧根离子浓度增大;
④O2+2H2O+4e-= 4OH-;
⑤N2H4-4e-+4OH-=N2↑+4H2O.
解析试题分析:(1)开关K与b连接是电解饱和食盐水,B极为阴极,电极反应式为2H++2e-=H2↑总反应的离子方程式为2Cl-+ 2H2O 2OH-+H2↑+Cl2↑;①阳离子向阴极移动,错误;②A极产生氯气,使湿润KI淀粉试纸变蓝,正确;③电解时从溶液中失去的是氯气和氢气,一段时间后加入HCl可恢复到电解前电解质的浓度,而不是盐酸,错误;④ 溶液不能转移电子,错误;
2OH-+H2↑+Cl2↑;①阳离子向阴极移动,错误;②A极产生氯气,使湿润KI淀粉试纸变蓝,正确;③电解时从溶液中失去的是氯气和氢气,一段时间后加入HCl可恢复到电解前电解质的浓度,而不是盐酸,错误;④ 溶液不能转移电子,错误;
(2)开关K与a连接装置为原电池,正极是氯气得到电子,负极为铁失去电子,变为+3价铁,电解反应式为Fe-3e-+3OH-=Fe(OH)3;
(3)①阳极氢氧根离子失去电子,4OH--4e-= 2H2O+O2↑;硫酸根离子通过阴离子交换膜,钾离子通过阳离子交换膜,故此时通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;②阴极氢离子放电生成氢气和碱,故在阴极产生氢氧化钾,从D口出;③氢离子放电,促进水的电离,氢氧根离子浓度增大;④该电池负极为氢气失去电子,正极为氧气得到电子,正极的电极反应式为O2+2H2O+4e-= 4OH-;⑤该电池肼在负极失去电子,注意碱性介质,需结合氢氧根离子生成水,负极电极反应式为N2H4-4e-+4OH-=N2↑+4H2O.
考点:考查电化学有关问题。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案部分难溶物的颜色和常温下的Ksp如下表所示:
| | Cu(OH)2 | CuOH | CuCl | Cu2O |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25 ℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | — |

某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ装置如图所示,接通电源后,发现a、b电极上均有气泡产生。
(1)电解过程中的总离子反应方程式为_________________________________________。
(2)为了确定电源的正、负极,下列操作一定行之有效的是 。
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示。

观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色。
(3) a极发生的电极反应方程式为________________________________________________________。
(4) 电解5 min后,b极发生的电极反应方程式为___________________________________________。
(5)12 min后,b极附近出现的橙黄色沉淀的成分是 ,原因是___________________________________________________________________________________。

 CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
 R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
R2Cu(有机相)+2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。 Ⅳ.电解硫酸铜溶液制得金属铜。
 4Al+3O2↑
4Al+3O2↑
 Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2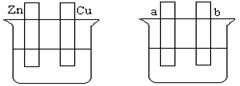
 ,
, 溶液,如有
溶液,如有 电子发生转移,试回答下列问题:
电子发生转移,试回答下列问题: 的质量是 ,得到
的质量是 ,得到 的体积(标准状况)是 。
的体积(标准状况)是 。 (填“变小”、“变大”或“不变”)
(填“变小”、“变大”或“不变”)